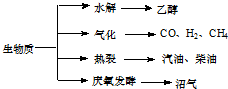
��Ŀ����
��1����ȩ��Һ�����ڽ�������걾������Ҫ�������˼�ȩ�ĺ��ֻ�ѧ����
��2�����������ܻ�õ�CO��H2�����Ժϳɶ����л����CO��H2�����ʵ���1��1����Ӧ����ԭ�������ʴ�100%���ϳɵ����ʿ�����
a������ b���״� c����ȩ d������
��3����ҵ�Ϻϳɼ״��ķ�Ӧ��CO��g��+2H2��g��?CH3OH��g����H=-90.8kJ/mol��
�����¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ����
��Ӧ�ﵽƽ��ʱ���й��������£�
| 1������ | 2���� | 3���� | 4���� |
| 5����Ӧ��Ͷ���� | 6.1molCO��2molH2 | 7��l molCH3OH | 8.2molCO��4molH2 |
| 9��CH30H��Ũ�ȣ�mol/L�� | 10��cl | 11��c2 | 12��c3 |
| 13����Ӧ�������仯 | 14���ų�Q1kJ | 15������Q2kJ | 16���ų�Q3kJ |
| 17��ƽ�ⳣ�� | 18��Kl | 19��K2 | 20��K3 |
| 21����Ӧ��ת���� | 22��al | 23��a2 | 24��a3 |
A��cl=c2 B.2Q1=Q3 C��KI=K3 D��a2+a3��100%
��4��һ���¶Ⱥ�ѹǿ�£�CO��H2���ϳɶ����ѵķ�ӦΪ��
3H2 ��g��+3CO ��g�� CH3OCH3 ��g��+CO2��g��
��һ����ɱ���ܱ������г���3mol H2��3molCO��l mol CH3OCH3��l mol CO2����һ��ʱ��ﵽƽ�⣬�����ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6����ƽ��ʱ
n��CH3OCH3��=
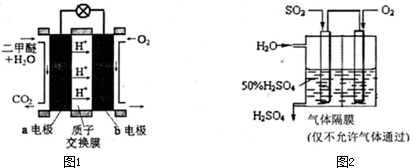
��5����ͼ1Ϊ��ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��b�缫��
��6��������������Դ�����л����SO2����������ͼ2��ʾװ�ã��õ绯ѧԭ����������Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬��ͨ��SO2��ˮ��������Ϊ
��2�����������غ㶨�ɺͻ��Ϸ�Ӧ�Ķ�����ص��жϣ���Ҫ�����÷�Ӧǰ��ԭ�ӵ�����䣬����Ŀ�ر��ֲ�������жϣ�
��3��A�����ݼ������ڵ�Чƽ����з�����
B������ѹǿƽ���������С�ķ����ƶ���
C��ƽ�ⳣ��ֻ���¶��йأ��¶Ȳ��䣬ƽ�ⳣ����ͬ��
D���������ʵ������ڼף����з�Ӧ��ת���ʴ��ڼף�
��4����Ӧǰ���������������䣬�ܶ�����˵��ƽ�����������ƶ���������ɼ��ѵ����ʵ���Ϊx�����ݲ�������������ɼ��ѵ����ʵ������ټ������Ӧ����ѵ������ʵ�����
��5������ԭ��ع���ԭ������������ʧ���ӣ������õ��ӣ����ݵ缫��ԭ���ԭ��д���缫��Ӧ��
��6������SO2��O2��ˮ�γ�������Һ��Ũ��Ϊ50%�����SO2��ˮ�������ȣ�
�ʴ�Ϊ��ʹ�����ʱ��ԣ�
��2������ɫ��ѧ����ʵ�����ŷţ�����Ӧ���е�ԭ�������ʴﵽ100%��Ҳ����˵��Ӧ����һ���ǻ��Ϸ�Ӧ���ҷ�Ӧ������еĸ�ԭ����Ŀ�Ȳ��䣬CO��H2��һ�������°��ղ�ͬ�ı�����Ӧ���ɼٶ���Ӧʱ�Ļ�ѧ������֮��Ϊ1��1����ֻҪ��ѡ���еĻ�ѧʽ�ܻ�Ϊ��ʽ��CO��n��H2��n��������ȷ�ģ������ǻ����״���CH4O���ɱ�Ϊ��CO��1��H2��2����ȩ��CH2O���ɱ�Ϊ��CO��1��H2��1�����ᣨC2H4O2���ɱ�Ϊ��CO��2��H2��2������cd��ȷ��
��ѡcd��
��3��A��1molCO��2molH2��1mol CH3OH�ĵ�Ч�ģ�ƽ��ʱCH3OH��Ũ��c1=c2����A��ȷ��
B�����ķ�Ӧ��Ͷ�����ǼĶ������ݻ���ͬ��ѹǿ�ȼ״�ƽ�����ҽ��У��ų�������2Q1��Q3����B����
C��ƽ�ⳣ��ֻ���¶��йأ��¶���ͬ��ƽ�ⳣ����ͬ����C��ȷ��
D�����ݷ�����֪��a1+a2=100%�����ڱ������ʵ�������ѹǿ����Ӧ���ת���ʴ��ڼģ���a3��a1��a3+a2��100%����D����
��ѡac��
��4����Ӧǰ���������������䣬ͬ�¡�ͬѹ�£��ﵽƽ��ʱ�������ܶ��������������С����Ӧ���������ƶ�������Ӧ���ʴ����淴Ӧ���ʣ�ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6�����������ʵ�����Ϊԭ�ȵ�
| 1 |
| 1.6 |
| 1 |
| 1.6 |
3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g����n�����٣�
1 4
x 3mol
��4x=3��1
��ã�x=0.75��
ƽ��ʱ���ѵ����ʵ���Ϊ��n��CH3OCH3��=1mol+0.75mol=1.75mol��
�ʴ�Ϊ��1.75��������Ӧǰ���������������䣬ͬ�¡�ͬѹ�£��ﵽƽ��ʱ�������ܶ��������������С��ƽ�����ƣ�
��5������ͼ1��֪�������õ��ӣ����ϼ۽��ͣ���b�缫����������a�缫��������ˮ��Ӧ���ɶ�����̼�������ӣ�����a�缫�ķ�ӦʽΪ����CH3��2O-12e-+3H2O=2CO2+12H+��
�ʴ�Ϊ��������CH3��2O-12e-+3H2O=2CO2+12H+��
��6���裺SO2��ˮ�������ֱ�Ϊa��b
SO2 +H2O?H2SO3
64 18 82
a
| 18a |
| 64 |
| 82a |
| 64 |
2H2SO3 +O2�T22H2SO4
164 196
| 82a |
| 64 |
| 98a |
| 64 |
��������Һ�������ٷ���Ϊ
| ||||
|
�����ɵ� a��b=16��29��
�ʴ�Ϊ��16��29��

(15��)��������Դ��һ����ȾС�Ŀ�������Դ�������ʵ���Ҫת��;������Ҫ��������ͼ��
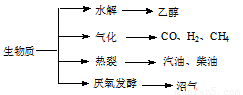
��1�������й�˵����ȷ���� �� ��
a���������ܣ�������������Դ��̫����
b������ά��ˮ���õ��Ҵ���ȼ������������������
c���������ѽ��õ����͡����͵����ڴ�����
d����ֲ��ո˵��������ͻ�õ���������Ҫ�ɷ��Ǽ���
��2�����������ܻ�õ�CO��H2�����Ժϳɼ״��Ͷ����ѣ�CH3OCH3���������������ʡ�������1��1����Ӧ����ԭ�������ʴ�100%���ϳɵ����ʿ����� ��
a������ b���״� c����ȩ d������
��3���״���һ����Ҫ�Ļ���ԭ�ϣ���ҵ�Ϻϳɼ״��ķ�Ӧ��
CO(g)��2H2(g) CH3OH(g) ��H= -90.8kJ��mol-1��
CH3OH(g) ��H= -90.8kJ��mol-1��
�����¶ȡ��ݻ���ͬ��3���ܱ������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��¡����ݣ���÷�Ӧ�ﵽƽ��ʱ���й��������£�
|
���� |
�� |
�� |
�� |
|
��Ӧ��Ͷ���� |
1molCO ��2molH2 |
1mol CH3OH |
2molCO��4molH2 |
|
CH3OH��Ũ�ȣ�mol/L�� |
c1 |
c2 |
c3 |
|
��Ӧ�������仯 |
�ų�Q1 kJ |
����Q2 kJ |
�ų�Q3 kJ |
|
ƽ�ⳣ�� |
K1 |
K2 |
K3 |
|
��Ӧ��ת���� |
�� 1 |
�� 2 |
�� 3 |
����˵����ȷ���� ��
a. c1 = c2 b. 2Q1 �� Q3 c. K1=K3 d. ��2+ ��3�� 100%
��4����һ���¶Ⱥ�ѹǿ�£�CO��H2���ϳɶ����ѵķ�ӦΪ��
3H2��g��+3CO��g��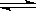 CH3OCH3��g��+CO2��g��
CH3OCH3��g��+CO2��g��
����һ����ɱ���ܱ������г���3 mol H2��3 mol CO��1 mol CH3OCH3��1 mol CO2����һ��ʱ��ﵽƽ�⣬�����ƽ��ʱ��������ܶ���ͬ��ͬѹ����ʼʱ��1.6�����ٷ�Ӧ��ʼʱ�����淴Ӧ���ʵĴ�С��v(����____v(��)��� >������ < ����=������������
��ƽ��ʱn(CH3OCH3)= mol��
����ͼΪ��ɫ��Դ��ֱ�Ӷ�����ȼ�ϵ�ء��Ĺ���ԭ��ʾ��ͼ��
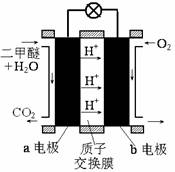
b�缫�� ����a�缫�ķ�ӦʽΪ ��
 ��������Դ��һ����ȾС�Ŀ�������Դ�������ʵ���Ҫת��;������Ҫ������ͼ��
��������Դ��һ����ȾС�Ŀ�������Դ�������ʵ���Ҫת��;������Ҫ������ͼ��