摘要:短周期元素A和B.其中:A元素的原子最外层电子数是a.次外层电子数是b,B元素的原子M层电子数是.则A.B两种元素形成化合物的化学式可能表示为( ) A.B3A2 B.BA2 C.A3B2 D.AB2
网址:http://m.1010jiajiao.com/timu3_id_394164[举报]
 短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:
短周期元素A、B、C、D、E、F,原子序数依次增大.已知:①A与E同主族,E的单质与D2反应可生成E2D和E2D2两种固体;②F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;③CA4++DA-=CA3↑+A2D,各种反应和生成物的电子数都与E+相等.请回答下列问题:(1)BD2的结构式为
O=C=O
O=C=O
,F的离子结构示意图为

三角锥型
三角锥型
.(2)废旧印刷电路板上含有铜,以往回收的方法是将其灼烧使用铜转化为氧化铜,再用稀硫酸来溶解.现改用A2D2和稀硫酸浸泡即达目的,又保护了环境,其反应的化学方程式为
Cu+H2O2+H2SO4=CuSO4+2H2O
Cu+H2O2+H2SO4=CuSO4+2H2O
;(3)在火箭推进器中装有强还原剂C2A4和强氧化剂A2D2,已知0.5mol液态C2A4和足量液态A2D2反应,生成一种无色无味无毒的气体和水蒸气,放出320kJ热量,写出该反应的热化学方程式
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-640kJ?mol-1
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g);△H=-640kJ?mol-1
.(4)离子化合物CA5的电子式为


| ||
| 2 |
| 3 |
| ||
| ||
| 2 |
| 3 |
| ||
短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
(1)E的简单离子的结构示意图为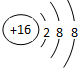
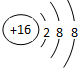 ;
;
(2)D在周期表中的位置为
(3)B和C简单离子的半径大小为
(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是
a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中只含离子键的是
查看习题详情和答案>>
| 元素编号 | 元素特征信息 |
| A | 最高正价和最低负价的绝对值之差为2 |
| B | 最外层电子数是内层电子数的3倍 |
| C | 1molC单质能与冷水反应,在标准状况下生成11.2LH2 |
| D | 原子最外层电子数等于其周期序数 |
| E | 负二价阴离子的电子层结构与Ar原子相同 |
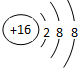
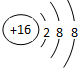
(2)D在周期表中的位置为
第三周期IIIA族
第三周期IIIA族
;(3)B和C简单离子的半径大小为
O2->Na+
O2->Na+
;(用离子符号和“>”、“=”或“<”表示)(4)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是
ad
ad
(填序号);a.比较两种单质的颜色 b.比较氢化物的稳定性
c.依据两元素在周期表中的位置 d.依据两元素单质在自然界中的存在状态
(5)B元素均可与另外四种元素中的一种形成化合物,其中只含离子键的是
Na2O、Al2O3
Na2O、Al2O3
(写化学式,下同),既含离子键又含共价键的是Na2O2
Na2O2
.短周期元素A、B、C的原子序数逐渐增大,它们形成的离子具有相同的电子层结构,B和C的单质都能跟水剧烈反应,B为电负性数值最大的元素.B单质与H2O反应产生A单质,0.5mol C单质跟水反应时,在标准状况下放出5.6L H2,此时C转化成具有氖原子核外电子层结构的离子.问:
(1)A、B、C各是什么元素?
(2)写出这三种元素所形成化合物的化学式,其中有一种淡黄色固体,写出它作为呼吸面具中供养剂时的所有反应原理,并指出氧化剂、还原剂.
查看习题详情和答案>>
(1)A、B、C各是什么元素?
(2)写出这三种元素所形成化合物的化学式,其中有一种淡黄色固体,写出它作为呼吸面具中供养剂时的所有反应原理,并指出氧化剂、还原剂.
 短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.
短周期元素A、B、C、D原子序数依次增大,且C元素最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子.A、C位于同一主族,A为非金属元素,B的最外层电子数是次外层的3倍,B、C的最外层电子数之和与D的最外层电子数相等.E单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏.请回答下列问题:
(1)C的最高价氧化物对应水化物电子式为
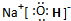
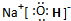
离子键、极性键
离子键、极性键
.(2)由上述A、B、C、D四种元素中的三种组成某种盐,水溶液显碱性,是家用消毒剂的主要成分.将该盐溶液滴入KI淀粉溶液中,溶液变为蓝色,则反应的离子方程式为
2I-+ClO-+H2O=I2+Cl-+2OH-
2I-+ClO-+H2O=I2+Cl-+2OH-
(3)用石墨电极电解CD的饱和溶液,若反应后溶液的体积为200mL,测得pH为13,则阳极得到的气体的物质的量为
0.01
0.01
mol.(4)E元素与D元素可形成ED2和ED3两种化合物,下列说法正确的是(填序号)
①③
①③
.①保存ED2溶液时,需向溶液中加入少量E单质
②ED2只能通过置换反应生成,ED3只能通过化合反应生成
③铜片、碳棒和ED3溶液组成原电池,电子由铜片沿导线流向碳棒④向淀粉碘化钾溶液和苯酚溶液中分别滴加几滴ED3的浓溶液,原无色溶液都变成紫色
(5)25℃时,将pH=4.00的A元素与D元素形成化合物AD的水溶液稀释1.00×103倍,则稀释后溶液中各离子浓度必遵循的定量等式关系式是
c(OH-)+c(Cl-)=c(H+)
c(OH-)+c(Cl-)=c(H+)
.(6)将一定量的D单质通入一定浓度的苛性钾溶液,两者恰好完全反应(已知反应过程放热),生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.该苛性钾溶液中KOH的质量是
16.8
16.8
.短周期元素A、B、C、D、E、F的原子序数依次增大.其中A和E、D和F分别位于同一主族,且B的最外层电子数是次外层电子数的2倍,D是地壳中含量最高的元素;化合物X、Y分别由A与C、A与D组成,且X、Y两种分子中均含有10个电子.
请回答下列问题:
(1)元素C在周期表中的位置是第
(2)Y的电子式为
 .
.
(3)比较F和E形成简单离子的半径大小:
(4)一定条件下,A单质和D单质在E的最高价氧化物对应水化物的浓溶液中可以形成燃料电池.请写出该燃料电池的负极反应式:
(5)X的空间构型为
查看习题详情和答案>>
请回答下列问题:
(1)元素C在周期表中的位置是第
二
二
周期ⅤA
ⅤA
族.(2)Y的电子式为


(3)比较F和E形成简单离子的半径大小:
S2->Na+
S2->Na+
(填离子符号).(4)一定条件下,A单质和D单质在E的最高价氧化物对应水化物的浓溶液中可以形成燃料电池.请写出该燃料电池的负极反应式:
H2+2OH-+2e-=2H2O
H2+2OH-+2e-=2H2O
.(5)X的空间构型为
三角锥
三角锥
,工业上生产X的反应中,若每生成a mol X时放出b kJ热量,则该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g)△H=-
kJ/mol
| 2b |
| a |
N2(g)+3H2(g)=2NH3(g)△H=-
kJ/mol
.| 2b |
| a |