网址:http://m.1010jiajiao.com/timu3_id_3940648[举报]
(11分)碘是人体的必需微量元素之一。加碘食盐中加重主的碘酸钾是一种白色结晶粉末,常温下很稳定。在酸性条件下碘酸钾是一种较强的氧化剂,可与碘化物等还原性物质反应。
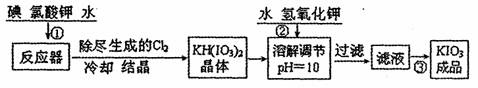
I.工业生产碘碳钾的流程如下:
|
已知步骤①发生反应为6I2+11KclO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑
反应中还原剂是 (填化学式),转移电子数为 。
II、已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O
(1)检验加碘食物中的碘元素。
学生甲利用碘酸与碘化钾在酸性条件下发生反应,检验是否有碘单质生成所需要的试剂是 ,判断碘单质存在的现象是 ;若要进一步分离提纯碘单质,用到的主要玻璃仪器有 。
(2)测定加碘食盐中碘的含量。学生乙设计的实验步骤如下:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol/L的Ns2S2O3溶液10.0mL,恰好完全反应(I2+2S2O2-3=2I-+S4O2-6)。则加碘食盐样品中的碘元素含量是 mg./kg(以含w的代数式表示)。
(3)有人认为可以用碘化钾代替食盐中的碘酸钾,学生丙又进行了下列实验:
| 操作步骤 | 实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 | 溶液无变化 |
| 滴入5滴淀粉溶液和1ml0.1mol/L KI溶液,振荡。 | 溶液无变化 |
| 然后再加入少量食醋,振荡。 | 溶液变蓝色 |
根据学生丙的实验结果,回答下列问题
①你认为能否用碘化钾代替食盐中的碘酸钾 (填“能、不能或不确定”)②你认为学生乙的实验结果 (填“偏高、偏低、无影响”)。
查看习题详情和答案>>测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸。
有关离子方程式为:4![]() +5HCHO+H+
+5HCHO+H+![]() 4Mn2++5CO2↑+11H2O
4Mn2++5CO2↑+11H2O
2![]() +5H
+5H![]() 2Mn2++10CO2 ↑+8H2O
2Mn2++10CO2 ↑+8H2O
测定装置:部分装置如下图所示(a、b为止水夹)

测定步骤:
①收集待检新装修的房屋居室空气
②准确量取5.00 mL 1.00×10-3 mol·L-1的高锰酸钾溶液于250 mL锥形瓶中,滴入3滴6 mol·L-1的H2SO4溶液,加水45 mL稀释备用。
③将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的房屋的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入高锰酸钾酸性溶液中,使其充分反应。再如此重复4次。
⑤用标准草酸溶液滴定锥形瓶中的溶液,记录滴定所消耗的草酸溶液的体积。
⑥再重复实验2次(每次所取的高锰酸钾溶液均为5.00 mL)。3次实验所消耗草酸溶液的体积平均值为12.38 mL。
完成以下问题:
(1)使用________量取5.00 mL高锰酸钾溶液。
(2)如果注射器压送气体速度过快,可能会产生什么不良后果?
___________________________。
(3)本实验是否需要外加指示剂?若需要,请指出指示剂的名称,若不需要,试说明如何确定滴定的终点。
___________________________。
(4)计算该居室内空气中甲醛的浓度_________mg·m-3,该居室的甲醛_________(填“是”或“否”)超标。
查看习题详情和答案>>、氰乙酸乙酯是精细化工的重要原料。此物质为有毒的液体,不溶于水,溶于碱溶液,与乙醇、乙醚等有机物混溶。
合成该物质是以A为起始物,经下列变化得到:
HClO Na2CO3 NaCN HCl A
A ① B ② C ③ D ④ E ⑤ F ⑥ G ⑦ 氰乙酸乙酯
已知:RCH=CH2 + HClO RCHClCH2OH ,
RCH2Cl + NaCN RCH2CN + NaCl 。
(1) a. ①的反应条件为 ;
b. 上述属于加成反应的是 ;属于取代反应的是 。(填序号)
c. ④的反应方程式为 。
(2)⑤的操作过程为:将NaCN 溶于水加热至50℃~60℃,然后滴入E溶液,温度在3min~5min内自然升到70℃,控制升温速度,维持80℃~90℃至反应结束。
a. E F反应为 反应(填“吸热”或“放热”)。
b.如何控制升温速度 。
(3) G与A、硫酸混合共沸蒸馏,蒸去反应生成的水及过量的A 至内温达到110℃,降温到40℃,得到氰乙酸乙酯的粗产品。粗产品中加入 溶液,静置后,进行 操作,然后再进行常压蒸馏和减压蒸馏,即可得到成品氰乙酸乙酯。
(4)产品中氰乙酸乙酯的含量≥92%为合格产品。产品含量的测定方法:称取样品1.000g置于锥形瓶中,用滴定管准确加入50mL 0.5 mol/L氢氧化钾乙醇溶液,置于沸水浴中回流1.5h,用10mL新煮沸的蒸馏水冲洗冷凝管内壁,冷却后,加入2滴1%酚酞乙醇指示剂,以0.5mol/L盐酸溶液滴定至粉红色消失,此时耗盐酸35.00mL。
a.能否用托盘天平称取样品 (填“能”或“不能”),理由是 。
b.该样品合格吗?(通过计算说明)
查看习题详情和答案>>
(1)下列说法正确的是__________。(选填序号)
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.一般在实验室点燃可燃性气体时,必须先要检验纯度
C.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
D.测定中和热时,环形玻璃搅拌棒要用力搅拌,使测得的温度更准确
E.测定硫酸铜晶体结晶水质量分数时,若用潮湿的坩埚会使测定结果偏大
F.石油蒸馏实验中,温度计必须插入液体中部。
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制 0.01 mol·L-1、0.008 mol·L-1等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
②样品处理
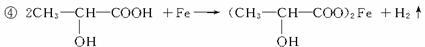
③准确量取一定体积的待测液于试管中(比色管),加入稍过量的KSCN溶液,并稀释至10 mL
④比色,直到与选取的标准颜色一致或相近即可。
试回答下列问题:
①配制100 mL 0.01 mol·L-1 [Fe(SCN)6]3-溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要___________、___________。
②步骤②脱色过程中包括加入:(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→(填操作)。
③比色法确定待测液的浓度其原理是:_____________________________________________。
④若某补铁剂是由乳酸(![]() )与铁粉作用生成的,请写出该反应的化学方程式:____________________________________________。
)与铁粉作用生成的,请写出该反应的化学方程式:____________________________________________。
(14分)Ⅰ.化学是一门以实验为基础的学科,下列实验操作描述中正确的是_ _
① 为使稀硫酸和锌制取氢气的速率加快,可向稀硫酸中加入用铜丝网包裹的锌粒
② 用托盘天平称取10. 4 g食盐时,将食盐放在右盘中的纸片上称量
③ 配制一定物质的量浓度的溶液时,容量瓶洗涤后未进行干燥
④ 以酚酞作指示剂,用标准浓度的盐酸滴定NaOH溶液,待溶液变成浅红色时即停止滴定
⑤ 测定溶液的pH时,用洁净、干燥的玻璃棒蘸取待测溶液,点在试纸中部,待变色后与标准比色卡对照读数
Ⅱ.201 1年3月12日,日本因大地震导致福岛核泄漏,主要泄漏物为碘131和绝137。在
被辐射地区,每天服用一片碘片可以起到一定的预防作用。我国部分地区出现抢购加碘食盐现象。为此卫生部有关专家指出多吃碘盐起不到预防放射性碘辐射的作用,且我国碘盐丰富,不必抢购。碘片和碘盐相关信息:
碘片:主要成分是碘化钾,每片含100毫克的碘,防核辐射每天服一片。
碘盐:加碘食盐,主要成分是氯化钠、碘酸钾,每公斤食用盐中碘含量为20—30毫克。
KIO3可用电解法制得:以石墨为阳极,不锈钢为阴极,在一定温度和电流下电解KI溶
液,总反应方程式为:KI+3H2O====KIO3 +3H2↑。
Na2S2O3可与I2反应:I2+2S2O32-(无色)→2I—+ S4O62-(无色)。回答下列问题:
(1)碘化钾、碘酸钾中的碘是碘127,则碘127和碘131的原子结构中不相同的是 ;以每公斤食用盐中碘含量为20毫克计,人每天吃____公斤盐才相当于服用一片碘片。说明靠吃碘盐来预防放射性碘 (填“有”、“无”)作用。
(2)电解法制KIO3中,阳极的电极反应式为_ ___;阴极附近pH值 (填“增大”、“减小”、“不变”)。
(3)为防止不法商贩乘机销售假冒加碘食盐,有关部门加强了检测。下面是对某超市出售的加碘精制盐的检测过程:
①取该食盐样品100.0 g加入适量的蒸馏水,振荡使固体完全溶解,然后加入用盐酸酸化的
淀粉- KI溶液,结果溶液呈蓝色,有关反应的离子方程式为 ;
②用0.010mol·L—1的Na2S2O3溶液滴定,当用去Na2S2O3溶液12.00mL时蓝色刚好褪去,
该加碘食盐中KIO3的含量为 mg/kg。由此可判定该食盐为 (填“合格”或“不合格”)产品。
查看习题详情和答案>>