摘要:容积相同的甲.乙密闭容器.甲为恒容.乙为恒压.分别充入2mol SO2和1mol O2.同时发生反应:2SO2(g)+O2(g)2SO3(g).同温度下分别达到平衡.测得甲中SO2的转化率为25%.下列说法中正确的是 A.反应过程中甲容器中的反应速率比乙中的大 B.甲容器反应达到平衡时所需时间比乙容器少 C.乙容器SO2的转化率大于25% D.平衡时.乙容器中SO2.O2.SO3的浓度之比一定为2:1:2
网址:http://m.1010jiajiao.com/timu3_id_392702[举报]
相同温度下,甲(恒容)、乙(恒压)、丙(恒容)3个密闭容器中发生可逆反应:
2SO2(g)+O2(g) 2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数
2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数
据如下表。下列正确的是
A.Q1 =Q3<Q2
B.达到平衡时,乙容器中SO2的体积分数最大
C.平衡时,甲、乙、丙3个容器中甲的平衡常数最小
D.若在上述条件下,反应生成1molSO3(s),则反应放热为98.5kJ
2SO2(g)+O2(g)
 2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数
2SO3(g)ΔH =" -197" kJ/mol。实验测得起始、平衡时的有关数据如下表。下列正确的是
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| SO2 | O2 | Ar | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
A.Q1 =Q3<Q2
B.达到平衡时,乙容器中SO2的体积分数最大
C.平衡时,甲、乙、丙3个容器中甲的平衡常数最小
D.若在上述条件下,反应生成1molSO3(s),则反应放热为98.5kJ
向甲、乙两个容积均为1L的恒容密闭容器中,分别充入2mol A、2 mol B和1 mol A、1 mol B。相同条件下,发生下列反应:A(g)+B(g) xC(g)
xC(g) 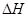 <0。测得两容器中c(A)随时间t的变化如图所示:
<0。测得两容器中c(A)随时间t的变化如图所示: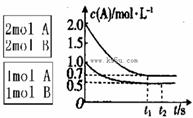
下列说法中正确的是
A.x可能等于2也可能等于1
B.向平衡后乙容器中充入氦气可使c(A)增大
C.将乙容器单独降温可使乙容器内各物质的体积分数与甲容器内的相同
D.若向甲容器中再充入2mol A、2 mol B,则平衡时甲容器中0.7 mol<n(B)<1.4 mol
有甲、乙两个容积均为1 L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g) ![]() xC(g),①向甲中通入4 mol A、2 mol
xC(g),①向甲中通入4 mol A、2 mol ![]() B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
(1)若乙W%=40%,且建立平衡的过程中乙压强有变化 ,则x = 。
(2)若乙W%=40%,且平衡时甲、乙压强不同,则乙平衡时c(A) = 。
(3)若x =4,则W% 40% (填“大于”、“小于”或“等于”)。
查看习题详情和答案>> xC(g),①向甲中通入4 mol A、2 mol
xC(g),①向甲中通入4 mol A、2 mol  B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答: xC(g),①向甲中通入4 mol A、2 mol
xC(g),①向甲中通入4 mol A、2 mol  B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答: