网址:http://m.1010jiajiao.com/timu3_id_392639[举报]
Ⅰ、下列实验操作或对实验事实的描述正确的是____________________
① 用量筒量取稀硫酸溶液8.0mL;
②中和热的测定实验中,可用金属丝(棒)代替环形搅拌玻璃棒;
③用热的浓盐酸洗涤附着有MnO2的试管;
④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;
⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;
⑥用碱式滴定管量取KMnO4溶液20.50mL ;
⑦将水沿烧杯内壁缓缓注入浓硫酸中,不断用玻璃棒搅拌以稀释浓硫酸;
⑧用湿润的pH试纸测量某溶液pH时,测量值一定比真实值小;
⑨锌和一定量稀硫酸反应,为加快速率而不影响H2的量可向溶液中加适量Cu(NO3)2晶体。
Ⅱ、2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+
N2(g)。△H<0
2CO2(g)+
N2(g)。△H<0
①该反应平衡常数表达式
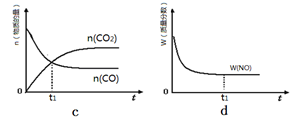
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。


(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
②2NO2(g)
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
查看习题详情和答案>>
Ⅰ、下列实验操作或对实验事实的描述正确的是____________________
① 用量筒量取稀硫酸溶液8.0mL;
②中和热的测定实验中,可用金属丝(棒)代替环形搅拌玻璃棒;
③用热的浓盐酸洗涤附着有MnO2的试管;
④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;
⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;
⑥用碱式滴定管量取KMnO4溶液20.50mL ;
⑦将水沿烧杯内壁缓缓注入浓硫酸中,不断用玻璃棒搅拌以稀释浓硫酸;
⑧用湿润的pH试纸测量某溶液pH时,测量值一定比真实值小;
⑨锌和一定量稀硫酸反应,为加快速率而不影响H2的量可向溶液中加适量Cu(NO3)2晶体。
Ⅱ、2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g) 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0
①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。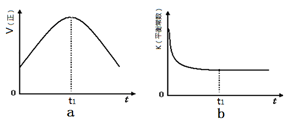
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
②2NO2(g)  N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol
③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
① 用量筒量取稀硫酸溶液8.0mL;
②中和热的测定实验中,可用金属丝(棒)代替环形搅拌玻璃棒;
③用热的浓盐酸洗涤附着有MnO2的试管;
④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高 ;
⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;
⑥用碱式滴定管量取KMnO4溶液20.50mL ;
⑦将水沿烧杯内壁缓缓注入浓硫酸中,不断用玻璃棒搅拌以稀释浓硫酸;
⑧用湿润的pH试纸测量某溶液pH时,测量值一定比真实值小;
⑨锌和一定量稀硫酸反应,为加快速率而不影响H2的量可向溶液中加适量Cu(NO3)2晶体。
Ⅱ、2013年初,雾霾天气多次肆虐天津、北京等地区。其中,燃煤和汽车尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g) + 2CO(g)
 2CO2(g)+ N2(g)。△H<0
2CO2(g)+ N2(g)。△H<0①该反应平衡常数表达式
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。


(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOX可以消除氮氧化物的污染。
已知:①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
②2NO2(g)
 N2O4(g) △H=-56.9 kJ/mol
N2O4(g) △H=-56.9 kJ/mol ③H2O(g) = H2O(l) ΔH = -44.0 kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式: 。
①实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉.
②配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低.
③将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦苯与溴水在铁粉的催化作用下制备溴苯
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
Ⅱ氟化钠是一种重要的氟盐,主要用于农作物杀菌、杀虫、木材的防腐.实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵;
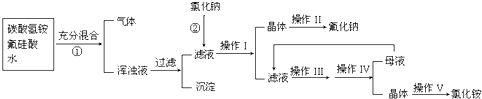
已知:20℃时氯化铵的溶解度为37.2g,氟化钠的溶解度为4g.Na2SiF6微溶于水.请回答下列问题:
(1)上述流程①中产生浑浊的原因是生成了
A.NH4F B.H2SiO3C.(NH4)2SiF6 D.(NH4)2CO3
(2)写出流程②中相关的化学方程式:
(3)操作I和操作
(4)流程①中NH4HCO3必须过量,其原因是
①实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉.
②配制一定浓度的溶液时,俯视容量瓶的刻线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低.
③将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末.
④实验室用铜片与稀硝酸反应产生的气体可用排水法收集.
⑤试管中加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现.
⑥向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同.
⑦苯与溴水在铁粉的催化作用下制备溴苯.
⑧分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多.
| A、①②④⑥ | B、①③④⑤⑥ | C、③④⑥⑦ | D、③⑦⑧ |