摘要: “酒是陈的香 .就是因为酒在储存过程中生成了有香味的乙酸乙酯.在实验室我们也可以用右图所示的装置制取乙酸乙酯.回答下列问题: (1)写出制取乙酸乙酯的化学反应方程式 . (2)在大试管中配制一定比例的乙醇.乙酸和浓硫酸的混合液的方法是: . (3)浓硫酸的作用是:① ,② . (4)饱和碳酸钠溶液的主要作用是 . (5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上.不能插入溶液中.目的是防止 . (6)若要把制得的乙酸乙酯分离出来.应采用的实验操作是 . (7)做此实验时.有时还向盛乙酸和乙醇的试管里加入几块碎瓷片.其目的是 . (8)生成乙酸乙酯的反应是可逆反应.反应物不能完全变成生成物.反应一段时间后. 就达到了该反应的限度.也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有 . ①单位时间里.生成1mol乙酸乙酯.同时生成1mol水 ②单位时间里.生成1mol乙酸乙酯.同时生成1mol乙酸 ③单位时间里.消耗1mol乙醇.同时消耗1mol乙酸 ④正反应的速率与逆反应的速率相等 ⑤混合物中各物质的浓度不再变化
网址:http://m.1010jiajiao.com/timu3_id_39238[举报]
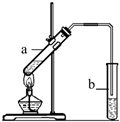 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:(1)写出制取乙酸乙酯的化学反应方程式
CH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2OCH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
. CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O(2)浓硫酸的作用是:①
催化作用
催化作用
;②吸水作用
吸水作用
.(3)饱和碳酸钠溶液的主要作用是
除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层
除去乙醇和乙酸、降低乙酸乙酯的溶解度,便于分层
.(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
倒吸
倒吸
.(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
用饱和碳酸钠溶液承接蒸馏出的乙酸乙酯,再分液
用饱和碳酸钠溶液承接蒸馏出的乙酸乙酯,再分液
.(6)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)
②④⑤
②④⑤
.①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化.
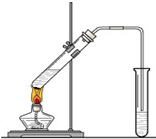 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:(1)乙醇、乙酸分子中的官能团分别是
羟基
羟基
、羧基
羧基
(2)装置中导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
倒吸
倒吸
.(3)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是
防止暴沸
防止暴沸
.(4)该反应属于哪类反应类型
BDE
BDE
.A.加成反应 B.取代反应 C.水解反应 D.酯化反应 E.可逆反应
(5)写出制取乙酸乙酯的化学反应方程式
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
| 浓硫酸 |
| △ |
CH3COOH+CH3CH2OH
CH3COOC2H5+H2O
.| 浓硫酸 |
| △ |
(6)无水乙酸又称冰醋酸(熔点16.6℃).在室温较低时,无水乙酸就会凝结成像冰一样的晶体.请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸?
水浴微热、用热毛巾热敷
水浴微热、用热毛巾热敷
.(7)乙醇在一定条件下还能发生脱水反应产生乙烯.乙烯通入溴的四氯化碳溶液中,观察到的现象是
溴水颜色褪去
溴水颜色褪去
;其反应方程式为CH2=CH2+Br-Br→CH2Br-CH2Br
CH2=CH2+Br-Br→CH2Br-CH2Br
.此外,乙烯能用来生产环氧乙烷,生产工艺主要有两种:
工艺一:
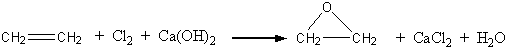
工艺二:
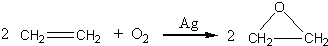
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,因此,在实际生产中,应采用
工艺二
工艺二
(填“工艺一”或“工艺二”)更环保、更经济. “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:(1)写出制取乙酸乙酯的化学反应方程式
CH3COOH+C2H5OH
CH3COOC2H5+H2O;
| 浓硫酸 |
| 加热 |
CH3COOH+C2H5OH
CH3COOC2H5+H2O;
;| 浓硫酸 |
| 加热 |
(2)浓硫酸的作用是:①
催化剂
催化剂
;②吸水剂
吸水剂
;(3)饱和碳酸钠溶液的主要作用是
冷却,酯在其中的溶解度更小,有利于酯分离,除去粗产品中的乙酸有利于闻到酯香味
冷却,酯在其中的溶解度更小,有利于酯分离,除去粗产品中的乙酸有利于闻到酯香味
;(4)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
倒吸
倒吸
.(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
分液
分液
. “酒是陈的香”,就是因为酒在储存过程中生成了有香 味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.
“酒是陈的香”,就是因为酒在储存过程中生成了有香 味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
CH3COOH+C2H5OH
CH3COOC2H5+H2O
| 浓硫酸 |
| △ |
CH3COOH+C2H5OH
CH3COOC2H5+H2O
| 浓硫酸 |
| △ |
(2)饱和碳酸钠溶液的主要作用是
中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味
中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味
、溶解挥发出来的乙醇,降低乙酸
溶解挥发出来的乙醇,降低乙酸
、乙酯在水中的溶解度,便于分层得到酯
乙酯在水中的溶解度,便于分层得到酯
.(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是
防倒吸
防倒吸
.(4)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
分液
分液
.(5)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是
防止大试管中液体暴沸而冲出导管
防止大试管中液体暴沸而冲出导管
.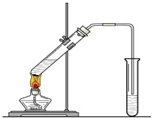 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯.回答下列问题:(1)写出制取乙酸乙酯的化学反应方程式
CH3COOH+C2H5OH
CH3COOC2H5+H2O
| 浓硫酸 |
| △ |
CH3COOH+C2H5OH
CH3COOC2H5+H2O
| 浓硫酸 |
| △ |
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:
先在大试管中加入乙醇,然后慢慢向其中注入硫酸,并不断搅拌,最后向装有乙醇和浓硫酸的混合物的大试管中加入乙酸
先在大试管中加入乙醇,然后慢慢向其中注入硫酸,并不断搅拌,最后向装有乙醇和浓硫酸的混合物的大试管中加入乙酸
.(3)浓硫酸的作用是:①
催化作用
催化作用
;②吸水作用
吸水作用
.(4)饱和碳酸钠溶液的主要作用是
酯在其中的溶解度更小,有利于酯分离,除去粗产品中的乙酸有利于闻到酯香味
酯在其中的溶解度更小,有利于酯分离,除去粗产品中的乙酸有利于闻到酯香味
.(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止
倒吸
倒吸
.(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是
分液
分液
.(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是
防止暴沸
防止暴沸
.(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态.下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号)
②④⑤
②④⑤
.①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化.