摘要:将一定量Na2O.Na2O2.Al组成的混合物投入足量水中.再滴加2 mol·LH2SO4100mL时产生沉淀最多.则混合物中Na2O和Na2O2的总物质的量为( ) A.无法确定 B.0.2mol C.0.4mol D.0.5mol 第II卷
网址:http://m.1010jiajiao.com/timu3_id_389294[举报]
 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol 据此回答以下问题:
(1)合成氨工业采取的下列措施中,不能用勒沙特列原理解释的是
②③
②③
(填序号).①反应压强为20Mpa~50Mpa ②500℃的高温 ③铁触媒作催化剂 ④将生成的氨液化并及时从体系中分离出来,未反应的N2、H2循环到合成塔中.
(2)一定条件下NH3的平衡体积分数随n(N2)变化如图所示(T-温度).则T2
<
<
T1(填>、=、<),判断的依据是:合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T1>T2
合成氨反应是放热反应,温度升高,平衡向逆反应方向移动,NH3的体积分数下降,所以T1>T2
(3)合成氨气所需的氢气可以由水煤气分离得到.涉及反应信息如下:
反应一:C(s)+H2O(g)?H2(g)+CO(g) 平衡常数K1
反应二:CO(g)+H2O(g)?H2(g)+CO2(g) 平衡常数K2
①K1的表达式:K1=
| c(H2)?c(CO) |
| c(H2O) |
| c(H2)?c(CO) |
| c(H2O) |
②将一定量的H2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 1 | 2 | 0.8 | 1.2 | 5 |
| 2 | 900 | 0.5 | 1 | 0.2 | 0.8 | 3 |
| 3 | T | a | b | c | d | t |
0.16 mol?L-1?min-1
0.16 mol?L-1?min-1
(Ⅱ) 在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为
D
D
(填序号)A.其它条件不变温度T<900℃B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应二,当升高温度时K2
减小
减小
(填“增大”、“减小”或“不变”).将一定量的NaOH和NaHCO3的混合物X放在密闭容器中加热,充分反应后生成V1 L 气体Z(V1≠0).反应后的固体残渣Y与过量的稀盐酸反应,又生成V2 L气体Z(V1、V2均为标准状况下气体的体积).下列判断错误的是
( )
( )
| A、Y的成分为Na2CO3 | ||
| B、Z的成分为CO2 | ||
| C、V1>V2 | ||
D、X中n(Na+)=
|
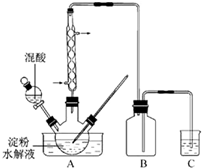 (2011?江苏)草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)
(2011?江苏)草酸是一种重要的化工产品.实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体.
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H 2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H 2C2O4+2HNO3→6CO2+2NO↑+4H2O
(1)检验淀粉是否水解完全所需用的试剂为
碘水
碘水
.(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是
由于温度过高、硝酸浓度过大,导致C6H12O6和H2C2O4进一步被氧化
由于温度过高、硝酸浓度过大,导致C6H12O6和H2C2O4进一步被氧化
.(3)装置C用于尾气吸收,当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NO,全部吸收,原因是
NO2+NO+2NaOH=2NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
(用化学方程式表示)(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是
优点:提高HNO3利用率
缺点:NOx吸收不完全
缺点:NOx吸收不完全
优点:提高HNO3利用率
缺点:NOx吸收不完全
.缺点:NOx吸收不完全
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有
布氏漏斗、吸滤瓶
布氏漏斗、吸滤瓶
.(2012?延边州模拟)物质A~M有如图1所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素,其他信息见下表:
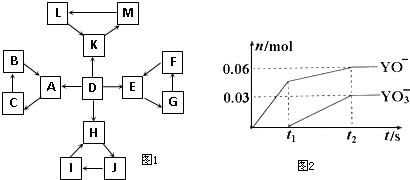
(1)写出H的电子式: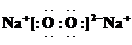
 .
.
(2)常温下测得一定浓度的C溶液的pH=11,用离子方程式表示其原因:
(3)写出向C溶液中通入过量CO2的离子方程式:
(4)金属铜与L浓溶液反应生成K,该反应的化学方程式是:
若标准状况下,生成K的体积为56L,此时转移的电子数为
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2 通入一定浓度的氢氧化钾溶液中,两者恰好完全反应时(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图2所示.写出该氢氧化钾溶液中通入Y2的总化学方程式:
查看习题详情和答案>>
| 编号 | 信 息 |
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性氧化物,不溶于水,能与某种酸反应 |
| 3 | F不溶于水,F用于制备干燥剂以及催化剂的载体 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业生产中的重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素 |
| 7 | K为酸雨的主要成分 |

(1)写出H的电子式:
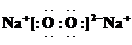
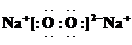
(2)常温下测得一定浓度的C溶液的pH=11,用离子方程式表示其原因:
AlO2-+2H2O?Al(OH)3+OH-
AlO2-+2H2O?Al(OH)3+OH-
.(3)写出向C溶液中通入过量CO2的离子方程式:
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
.(4)金属铜与L浓溶液反应生成K,该反应的化学方程式是:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
若标准状况下,生成K的体积为56L,此时转移的电子数为
5NA
5NA
,为了防止K对环境的污染,实验室常用氢氧化钠溶液
氢氧化钠溶液
试剂来吸收.(5)电解饱和J溶液产物之一为Y2,将一定量的Y2 通入一定浓度的氢氧化钾溶液中,两者恰好完全反应时(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图2所示.写出该氢氧化钾溶液中通入Y2的总化学方程式:
5Cl2+10KOH═7KCl+2KClO+KClO3+5H2O
5Cl2+10KOH═7KCl+2KClO+KClO3+5H2O
.