题目内容
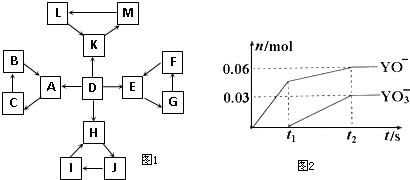
(2012?延边州模拟)物质A~M有如图1所示的转化关系.图中所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素,其他信息见下表:
(1)写出H的电子式: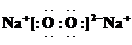
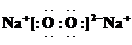 .
.
(2)常温下测得一定浓度的C溶液的pH=11,用离子方程式表示其原因:
(3)写出向C溶液中通入过量CO2的离子方程式:
(4)金属铜与L浓溶液反应生成K,该反应的化学方程式是:
若标准状况下,生成K的体积为56L,此时转移的电子数为
(5)电解饱和J溶液产物之一为Y2,将一定量的Y2 通入一定浓度的氢氧化钾溶液中,两者恰好完全反应时(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图2所示.写出该氢氧化钾溶液中通入Y2的总化学方程式:
| 编号 | 信 息 |
| 1 | D为地壳中含量最高的元素组成的单质 |
| 2 | E为酸性氧化物,不溶于水,能与某种酸反应 |
| 3 | F不溶于水,F用于制备干燥剂以及催化剂的载体 |
| 4 | H为淡黄色固体化合物 |
| 5 | 电解饱和J溶液是工业生产中的重要反应 |
| 6 | C为离子化合物,阴、阳离子均含有金属元素 |
| 7 | K为酸雨的主要成分 |

(1)写出H的电子式:
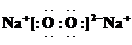
(2)常温下测得一定浓度的C溶液的pH=11,用离子方程式表示其原因:
AlO2-+2H2O?Al(OH)3+OH-
AlO2-+2H2O?Al(OH)3+OH-
.(3)写出向C溶液中通入过量CO2的离子方程式:
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
.(4)金属铜与L浓溶液反应生成K,该反应的化学方程式是:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
| ||
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O
.
| ||
若标准状况下,生成K的体积为56L,此时转移的电子数为
5NA
5NA
,为了防止K对环境的污染,实验室常用氢氧化钠溶液
氢氧化钠溶液
试剂来吸收.(5)电解饱和J溶液产物之一为Y2,将一定量的Y2 通入一定浓度的氢氧化钾溶液中,两者恰好完全反应时(已知反应过程放热),生成物中有三种含Y元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如图2所示.写出该氢氧化钾溶液中通入Y2的总化学方程式:
5Cl2+10KOH═7KCl+2KClO+KClO3+5H2O
5Cl2+10KOH═7KCl+2KClO+KClO3+5H2O
.分析:所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素,
D为地壳中含量最高的元素组成的单质,则D是O2;
E为酸性氧化物,不溶于水,能与某种酸反应,则E是SiO2,F不溶于水,F用于制备干燥剂以及催化剂的载体,F发生反应生成二氧化硅,则F是H2SiO3,
G能生成硅酸,二氧化硅能发生G,G是可溶性盐,所以G是Na2SiO3;
H为淡黄色固体化合物,且H含有第三周期元素,则为Na2O2,
电解饱和J溶液是工业生产中的重要反应,过氧化钠能转化J,则J是NaCl,
I能转化为Na2O2,且I含有第三周期元素,所以I是Na;
C为离子化合物,阴、阳离子均含有金属元素,且含有第三周期元素,所以C是NaAlO2,
氧气反应生成A,A能转化为偏铝酸钠,则A是Al2O3,
B能生成Al2O3,NaAlO2能转化为B,则B是Al(OH)3;
K是酸雨的主要成分,且属于氧化物,K含有第三周期元素,所以K是SO2,
金属铜与L浓溶液反应生成SO2,L是H2SO4,
二氧化硫被氧化生成三氧化硫,三氧化硫和水反应生成硫酸,所以M是SO3,
结合物质的性质分析解答.
D为地壳中含量最高的元素组成的单质,则D是O2;
E为酸性氧化物,不溶于水,能与某种酸反应,则E是SiO2,F不溶于水,F用于制备干燥剂以及催化剂的载体,F发生反应生成二氧化硅,则F是H2SiO3,
G能生成硅酸,二氧化硅能发生G,G是可溶性盐,所以G是Na2SiO3;
H为淡黄色固体化合物,且H含有第三周期元素,则为Na2O2,
电解饱和J溶液是工业生产中的重要反应,过氧化钠能转化J,则J是NaCl,
I能转化为Na2O2,且I含有第三周期元素,所以I是Na;
C为离子化合物,阴、阳离子均含有金属元素,且含有第三周期元素,所以C是NaAlO2,
氧气反应生成A,A能转化为偏铝酸钠,则A是Al2O3,
B能生成Al2O3,NaAlO2能转化为B,则B是Al(OH)3;
K是酸雨的主要成分,且属于氧化物,K含有第三周期元素,所以K是SO2,
金属铜与L浓溶液反应生成SO2,L是H2SO4,
二氧化硫被氧化生成三氧化硫,三氧化硫和水反应生成硫酸,所以M是SO3,
结合物质的性质分析解答.
解答:解:所有物质均由短周期元素组成,且每个小三角形内的三种物质均至少含有第三周期中的一种相同元素,
D为地壳中含量最高的元素组成的单质,则D是O2;
E为酸性氧化物,不溶于水,能与某种酸反应,则E是SiO2,
F不溶于水,F用于制备干燥剂以及催化剂的载体,F发生反应生成二氧化硅,则F是H2SiO3,
G能生成硅酸,二氧化硅能发生G,G是可溶性盐,所以G是Na2SiO3;
H为淡黄色固体化合物,且H含有第三周期元素,则为Na2O2,
电解饱和J溶液是工业生产中的重要反应,过氧化钠能转化J,则J是NaCl,
I能转化为Na2O2,且I含有第三周期元素,所以I是Na;
C为离子化合物,阴、阳离子均含有金属元素,且含有第三周期元素,所以C是NaAlO2,
氧气反应生成A,A能转化为偏铝酸钠,则A是Al2O3,
B能生成Al2O3,NaAlO2能转化为B,则B是Al(OH)3;
K是酸雨的主要成分,且属于氧化物,K含有第三周期元素,所以K是SO2,
金属铜与L浓溶液反应生成SO2,L是H2SO4,
二氧化硫被氧化生成三氧化硫,三氧化硫和水反应生成硫酸,所以M是SO3,
(1)通过以上分析知,H为过氧化钠,其电子式为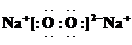 ,
,
故答案为: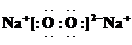 ;
;
(2)C是NaAlO2,偏铝酸钠是强碱弱酸盐,偏铝酸根离子易水解而使其溶液呈碱性,水解离子方程式为:AlO2-+2H2O?Al(OH)3+OH-,
故答案为:AlO2-+2H2O?Al(OH)3+OH-;
(3)偏铝酸钠和二氧化碳、水反应生成氢氧化铝程度和碳酸氢钠,离子方程式为
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(4)铜和浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,反应方程式为:
Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
若标准状况下,生成SO2的体积为56L,此时转移的电子数=
×(6-4)×NA=5NA,
二氧化硫属于酸性氧化物,能和碱反应生成盐,为防止污染,实验室常用氢氧化钠溶液吸收二氧化硫,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;5NA;NaOH浓溶液(或强碱浓溶液);
(5)电解饱和NaCl溶液产物之一为Y2,将一定量的Y2 通入一定浓度的氢氧化钾溶液中,两者恰好完全反应时(已知反应过程放热),则Y是Cl元素,生成物中有三种含Cl元素的离子,
根据图象知,ClO-的物质的量为0.06mol,ClO3-的物质的量是0.03mol,
根据转移电子守恒得n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,
根据氯原子守恒得氯气的物质的量=
=0.15mol,
根据原子守恒及转移电子守恒得该反应方程式为5Cl2+10KOH═7KCl+2KClO+KClO3+5H2O,
故答案为:5Cl2+10KOH═7KCl+2KClO+KClO3+5H2O.
D为地壳中含量最高的元素组成的单质,则D是O2;
E为酸性氧化物,不溶于水,能与某种酸反应,则E是SiO2,
F不溶于水,F用于制备干燥剂以及催化剂的载体,F发生反应生成二氧化硅,则F是H2SiO3,
G能生成硅酸,二氧化硅能发生G,G是可溶性盐,所以G是Na2SiO3;
H为淡黄色固体化合物,且H含有第三周期元素,则为Na2O2,
电解饱和J溶液是工业生产中的重要反应,过氧化钠能转化J,则J是NaCl,
I能转化为Na2O2,且I含有第三周期元素,所以I是Na;
C为离子化合物,阴、阳离子均含有金属元素,且含有第三周期元素,所以C是NaAlO2,
氧气反应生成A,A能转化为偏铝酸钠,则A是Al2O3,
B能生成Al2O3,NaAlO2能转化为B,则B是Al(OH)3;
K是酸雨的主要成分,且属于氧化物,K含有第三周期元素,所以K是SO2,
金属铜与L浓溶液反应生成SO2,L是H2SO4,
二氧化硫被氧化生成三氧化硫,三氧化硫和水反应生成硫酸,所以M是SO3,
(1)通过以上分析知,H为过氧化钠,其电子式为
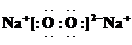 ,
,故答案为:
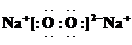 ;
;(2)C是NaAlO2,偏铝酸钠是强碱弱酸盐,偏铝酸根离子易水解而使其溶液呈碱性,水解离子方程式为:AlO2-+2H2O?Al(OH)3+OH-,
故答案为:AlO2-+2H2O?Al(OH)3+OH-;
(3)偏铝酸钠和二氧化碳、水反应生成氢氧化铝程度和碳酸氢钠,离子方程式为
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(4)铜和浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,反应方程式为:
Cu+2H2SO4(浓)
| ||
若标准状况下,生成SO2的体积为56L,此时转移的电子数=
| 56L |
| 22.4L/mol |
二氧化硫属于酸性氧化物,能和碱反应生成盐,为防止污染,实验室常用氢氧化钠溶液吸收二氧化硫,
故答案为:Cu+2H2SO4(浓)
| ||
(5)电解饱和NaCl溶液产物之一为Y2,将一定量的Y2 通入一定浓度的氢氧化钾溶液中,两者恰好完全反应时(已知反应过程放热),则Y是Cl元素,生成物中有三种含Cl元素的离子,
根据图象知,ClO-的物质的量为0.06mol,ClO3-的物质的量是0.03mol,
根据转移电子守恒得n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,
根据氯原子守恒得氯气的物质的量=
| (0.21+0.06+0.03)mol |
| 2 |
根据原子守恒及转移电子守恒得该反应方程式为5Cl2+10KOH═7KCl+2KClO+KClO3+5H2O,
故答案为:5Cl2+10KOH═7KCl+2KClO+KClO3+5H2O.
点评:本题考查物质的推断,根据物质的特点来分析推断物质,D的推断是本题的题眼,难度中等,注意离子方程式的书写规则,为易错点.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目