网址:http://m.1010jiajiao.com/timu3_id_38505[举报]
(1)制取氨气的化学方程式为:
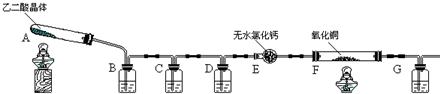
(2)三位同学都用向下排空气法收集氨气,其原因是
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为那位同学能够达到实验目的
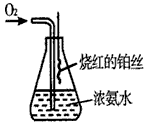
(6)某课外活动小组查阅有关资料知,铂丝是氨氧化的催化剂.并设计进行了如图实验.实验过程中观察到:瓶口气体变为红棕色,瓶内出现白烟
写出此实验过程中化学反应方程式:
| ||
| 高温高压 |
| ||
| 高温高压 |
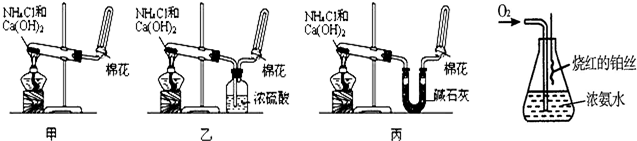
(08长沙雅礼中学一模)(16分)某课外实验小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO。(图中夹持装置已略去)
 |
(1)装置C中盛放 溶液;D的作用是 ;
(2)证明分解产物中有CO的现象是 ;
(3)该装置有一个不足之处,请写出 ;
(4)某同学查阅相关资料:草酸是二元酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。因此该同学认为:需要在装置B之前增加一个装有________(填写下列编号字母)的洗气装置。
a.水 b.NaOH 溶液 c.Na2CO3 溶液 d.饱和NaHCO3 溶液
(5)草酸可以在酸性条件下被KMnO4氧化,反应的离子方程式为:
2MnO4- + 5H2C2O4 +6 H+ = 2Mn2+ +10 CO2↑+8 H2O
实验室常用草酸钠标定KMnO4溶液。操作如下:准确称取2.680 g草酸钠,放入锥形瓶中,加100 mL稀硫酸溶解,将锥形瓶置于 (填“酸式” “碱式”)滴定管下,用KMnO4溶液滴定。当 时,即达到滴定终点。重复上述滴定操作三次,实验数据如下表所示。
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | 第四次终点 |
滴定管 液面刻度 | 0.00 mL | 20.02 mL | 21.00mL | 19.98 mL | 20.00mL |
KMnO4溶液的物质的量浓度的是c(KMnO4)= mol?L-1。
查看习题详情和答案>>(1)制取氨气的化学方程式为:______;
(2)三位同学都用向下排空气法收集氨气,其原因是______;
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是______填(“甲”、“乙”或“丙”);
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论):______.
(5)三位同学都认为,采用上述各自的装置,还可用于加热碳酸氢铵固体的方法来制取纯净的氨气,你认为那位同学能够达到实验目的______(填“甲”、“乙”或“丙”).他们还认为,装置中的NH4HCO3固体可用NH4Cl固体代替,你认为______(填“能”或“不能”).
(6)某课外活动小组查阅有关资料知,铂丝是氨氧化的催化剂.并设计进行了如图实验.实验过程中观察到:瓶口气体变为红棕色,瓶内出现白烟
写出此实验过程中化学反应方程式:______高温高压4NO+6H2O 查看习题详情和答案>>
(1)制取氨气的化学方程式为:________________________;
(2)三位同学都用向下排空气法收集氨气,其原因是________________________;
(3)三位同学用上述装置制取氨气时,其中有一位同学没有收集到氨(实验操作都正确),你认为没有收集到氨气的同学是______填(“甲”、“乙”或“丙”);
(4)检验氨气是否收集满的方法是(简述操作方法、现象和结论): ________________________。
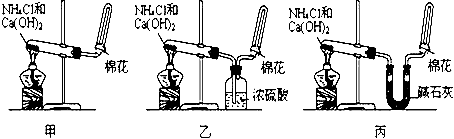
NH4HCO3固体可用NH4Cl固体代替,你认为___________(填“能”或“不能”)。
(6)某课外活动小组查阅有关资料知,铂丝是氨氧化的催化剂。并设计进行了如图实验。实验过程中观察到:瓶口气体变为红棕色,瓶内出现白烟。 写出此实验过程中化学反应方程式:
________________________;________________________
________________________;________________________