摘要:平行板电容器板间距离为d.A极板接地.B极板的电势随时间做周期性变化的规律如图所示.电势绝对值为φ0.电子电荷量为e.荷质比为k.在t=0时刻从A板释放电子.电子的初动能视为零. (1)为使电子打到B板时的动能最大.周期T应满足什么条件?这个最大动能Ek是多大? (2)若周期取满足上一问的最小值.而将电子在t=T/4时刻释放.电子能否打到B板上?若能.打到B板时的动能是多大?若不能.电子和B板间的最近距离是多大?
网址:http://m.1010jiajiao.com/timu3_id_38329[举报]
【化学-选修3物质结构与性质】
A、B、C、D、E、F是原子序数依次增大的前四周期元素.A、B、C三种元素的基态原子具有相同的能级和能层,且第一电离能的顺序为A<C<B,其中C原子基态时2p轨道有两个未成对电子;D与A同族,其单质为常用的半导体材料;E为前四周期由负性最小的元素;F原子内层无空轨道,最外层电子数与E相同.请回答:
(1)F的价层电子排布为 ;化合物F2C与稀硫酸反应的产物之一为红色固体,且反应中只有F元素的化合价发生了变化,该反应的离子方程为 .
(2)比较A、D的氢化物.稳定性:前者 后者;沸点:前者 后者(填“<”或“>”).
(3)C与氢元素形成的正一价离子含有10电子,该离子中C原子的杂化方式为 ;该离子的空间构型为 .C与氢元素形成的一种分子M的电子总数与E离子核外电子数相等,M分子为 分子(填“极性”或“非极性”).
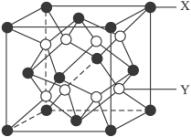
(4)1molAC2分子中π键的数目为 个;B、C形成的正一价离子N与AC2互为等电子体,N的电子式为 ;
(5)AC2分子构成的晶体结构如图,已知最近的两个分子间距离为
acm阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3.
查看习题详情和答案>>
A、B、C、D、E、F是原子序数依次增大的前四周期元素.A、B、C三种元素的基态原子具有相同的能级和能层,且第一电离能的顺序为A<C<B,其中C原子基态时2p轨道有两个未成对电子;D与A同族,其单质为常用的半导体材料;E为前四周期由负性最小的元素;F原子内层无空轨道,最外层电子数与E相同.请回答:
(1)F的价层电子排布为
(2)比较A、D的氢化物.稳定性:前者
(3)C与氢元素形成的正一价离子含有10电子,该离子中C原子的杂化方式为
(4)1molAC2分子中π键的数目为

(5)AC2分子构成的晶体结构如图,已知最近的两个分子间距离为
| 2 |
 【化学-选修物质结构与性质】
【化学-选修物质结构与性质】已知A、B、C、D均为周期表中前36号元素,且原子序数依次增大.A、B、C为同一周期的主族元素,A原子最外层有3个未成对电子,B原子p能级电子总数与s能级电子总数相等.D是周期表1-18列中的第10列元素.请回答:
(l)C的电子排布图为
(2)A、B两元素的第一电离能较大的是
(3)A的氢化物的VSEPR模型立体结构为
(4)D属于元素周期表中第
(5)元素D的氧化物DO晶体结构与NaCl晶体结构相同,已知D2+与最近O2-的核间距离为acm,DO的摩尔质量为Mg/mol,若用“NAA表示阿伏加德罗常数,则DO晶体的密度为
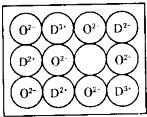
(6)天然的和绝大部分人工制备的晶体都存在各种缺陷,某种DO晶体中就存在如图所示的缺陷:一个D2+空缺,另有两个D2+被两个D3+所取代.其结果晶体仍呈电中性,但化合物中D和O的比值却发生了变化.其氧化D样品组成为D0.97O,则该晶体中D3+与D2+的离子个数比为
 已知NaCl的摩尔质量为58.5g?mol-1,其晶体密度为d g?cm-3,若右图中钠离子与最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示( )
已知NaCl的摩尔质量为58.5g?mol-1,其晶体密度为d g?cm-3,若右图中钠离子与最接近的氯离子的核间距离为a cm,那么阿伏加德罗常数的值可表示( )