题目内容
 【化学-选修物质结构与性质】
【化学-选修物质结构与性质】已知A、B、C、D均为周期表中前36号元素,且原子序数依次增大.A、B、C为同一周期的主族元素,A原子最外层有3个未成对电子,B原子p能级电子总数与s能级电子总数相等.D是周期表1-18列中的第10列元素.请回答:
(l)C的电子排布图为
(2)A、B两元素的第一电离能较大的是
(3)A的氢化物的VSEPR模型立体结构为
(4)D属于元素周期表中第
(5)元素D的氧化物DO晶体结构与NaCl晶体结构相同,已知D2+与最近O2-的核间距离为acm,DO的摩尔质量为Mg/mol,若用“NAA表示阿伏加德罗常数,则DO晶体的密度为
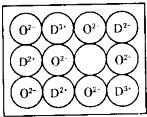
(6)天然的和绝大部分人工制备的晶体都存在各种缺陷,某种DO晶体中就存在如图所示的缺陷:一个D2+空缺,另有两个D2+被两个D3+所取代.其结果晶体仍呈电中性,但化合物中D和O的比值却发生了变化.其氧化D样品组成为D0.97O,则该晶体中D3+与D2+的离子个数比为
分析:A、B、C、D均为周期表中前36号元素,且原子序数依次增大.D是周期表1-18列中的第10列元素,则D为Ni;A、B、C为同一周期的主族元素,则处于短周期,B原子p能级电子总数与s能级电子总数相等,则B原子核外电子排布为1s22s22p4或1s22s22p63s2,A原子最外层有3个未成对电子,则其外围电子排布为ns2np3,处于ⅤA族,结合原子序数可知,A为N、B为O、C为F,据此解答.
解答:解:A、B、C、D均为周期表中前36号元素,且原子序数依次增大.D是周期表1-18列中的第10列元素,则D为Ni;A、B、C为同一周期的主族元素,则处于短周期,B原子p能级电子总数与s能级电子总数相等,则B原子核外电子排布为1s22s22p4或1s22s22p63s2,A原子最外层有3个未成对电子,则其外围电子排布为ns2np3,处于ⅤA族,结合原子序数可知,A为N、B为O、C为F,
(1)C为F元素,原子核外有9个电子,核外电子排布图为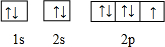 ,故答案为:
,故答案为: ;
;
(2)A、B两元素分别为N、O元素,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能较大的是N元素,故答案为:N;
(3)A的氢化物为CH4,C原子价层电子对数为4,其VSEPR模型立体结构为正四面体,故答案为:正四面体;
(4)D为Ni元素,属于28号元素,属于元素周期表中第四周期第Ⅷ族元素,它的+2价离子的电子排布式为1s22s22p63s23p63d8,
故答案为:四;Ⅷ;1s22s22p63s23p63d8;
(5)元素D的氧化物NiO晶体结构与NaCl晶体结构相同,Ni2+处于面心、棱中心,O2-处于面心与顶点上,则晶胞中Ni2+数目=1+12×
=4、O2-数目=6×
+8×
=4,故晶胞质量=
g,Ni2+与最近O2-的核间距离为acm,则晶胞棱长为2a cm,故晶胞的体积=(2a cm)3=8a3 cm3,故NiO晶体的密度=
=
g/cm3,
故答案为:
g/cm3;
(6)设1mol Ni0.97O中含Ni3+xmol,Ni2+为(0.97-x)mol,晶体呈电中性,可知3x+2×(0.97-x)=2×1,解得x=0.06mol,故Ni2+为(0.97-x)mol=0.91mol,Ni3+、Ni2+的数目之比=0.06:0.91=6:91,
故答案为:6:91.
(1)C为F元素,原子核外有9个电子,核外电子排布图为
 ,故答案为:
,故答案为: ;
;(2)A、B两元素分别为N、O元素,N元素原子2p能级容纳3个电子,为半满稳定状态,能量较低,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能较大的是N元素,故答案为:N;
(3)A的氢化物为CH4,C原子价层电子对数为4,其VSEPR模型立体结构为正四面体,故答案为:正四面体;
(4)D为Ni元素,属于28号元素,属于元素周期表中第四周期第Ⅷ族元素,它的+2价离子的电子排布式为1s22s22p63s23p63d8,
故答案为:四;Ⅷ;1s22s22p63s23p63d8;
(5)元素D的氧化物NiO晶体结构与NaCl晶体结构相同,Ni2+处于面心、棱中心,O2-处于面心与顶点上,则晶胞中Ni2+数目=1+12×
| 1 |
| 4 |
| 1 |
| 2 |
| 1 |
| 8 |
| 4×M |
| NA |
| ||
| 8a3 cm3 |
| M |
| 2NAa3 |
故答案为:
| M |
| 2NAa3 |
(6)设1mol Ni0.97O中含Ni3+xmol,Ni2+为(0.97-x)mol,晶体呈电中性,可知3x+2×(0.97-x)=2×1,解得x=0.06mol,故Ni2+为(0.97-x)mol=0.91mol,Ni3+、Ni2+的数目之比=0.06:0.91=6:91,
故答案为:6:91.
点评:本题考查物质结构与性质,涉及核外电子排布、电离能、价层电子对互斥理论、晶胞结构与计算等,难度中等,(5)为易错点、难点,题目没有给出具体的晶胞结构,注意识记中学常见的晶胞结构.

练习册系列答案
相关题目
 【化学--选修物质结构与性质】
【化学--选修物质结构与性质】