题目内容
【化学-选修3物质结构与性质】
A、B、C、D、E、F是原子序数依次增大的前四周期元素.A、B、C三种元素的基态原子具有相同的能级和能层,且第一电离能的顺序为A<C<B,其中C原子基态时2p轨道有两个未成对电子;D与A同族,其单质为常用的半导体材料;E为前四周期由负性最小的元素;F原子内层无空轨道,最外层电子数与E相同.请回答:
(1)F的价层电子排布为 ;化合物F2C与稀硫酸反应的产物之一为红色固体,且反应中只有F元素的化合价发生了变化,该反应的离子方程为 .
(2)比较A、D的氢化物.稳定性:前者 后者;沸点:前者 后者(填“<”或“>”).
(3)C与氢元素形成的正一价离子含有10电子,该离子中C原子的杂化方式为 ;该离子的空间构型为 .C与氢元素形成的一种分子M的电子总数与E离子核外电子数相等,M分子为 分子(填“极性”或“非极性”).
(4)1molAC2分子中π键的数目为 个;B、C形成的正一价离子N与AC2互为等电子体,N的电子式为 ;
(5)AC2分子构成的晶体结构如图,已知最近的两个分子间距离为
acm阿伏伽德罗常数为NA,则该晶体的密度为 g/cm3.
A、B、C、D、E、F是原子序数依次增大的前四周期元素.A、B、C三种元素的基态原子具有相同的能级和能层,且第一电离能的顺序为A<C<B,其中C原子基态时2p轨道有两个未成对电子;D与A同族,其单质为常用的半导体材料;E为前四周期由负性最小的元素;F原子内层无空轨道,最外层电子数与E相同.请回答:
(1)F的价层电子排布为
(2)比较A、D的氢化物.稳定性:前者
(3)C与氢元素形成的正一价离子含有10电子,该离子中C原子的杂化方式为
(4)1molAC2分子中π键的数目为

(5)AC2分子构成的晶体结构如图,已知最近的两个分子间距离为
| 2 |
分析:A、B、C、D、E、F是原子序数依次增大的前四周期元素.E为前四周期电负性最小的元素,则E为K元素;A、B、C三种元素的基态原子具有相同的能级和能层,三种处于同一周期,其中C原子基态时2p轨道有两个未成对电子,则三元素处于第二周期,C原子外围电子排布为2s22p2或2s22p4,第一电离能的顺序为A<C<B,则B元素原子的2p能级为半满稳定状态,其外围电子排布为2s22p3,故B为氮元素,C原子外围电子排布为2s22p4,则C为氧元素;A原子外围电子排布为2s22p1或2s22p2,D与A同族,其单质为常用的半导体材料,处于ⅣA族,则A为碳元素、D为Si元素;F原子内层无空轨道,最外层电子数与E相同,则F原子核外电子排布式为1s22s22p63s23p63d104s1,则F为Cu元素,据此解答.
解答:解:A、B、C、D、E、F是原子序数依次增大的前四周期元素.E为前四周期电负性最小的元素,则E为K元素;A、B、C三种元素的基态原子具有相同的能级和能层,三种处于同一周期,其中C原子基态时2p轨道有两个未成对电子,则三元素处于第二周期,C原子外围电子排布为2s22p2或2s22p4,第一电离能的顺序为A<C<B,则B元素原子的2p能级为半满稳定状态,其外围电子排布为2s22p3,故B为氮元素,C原子外围电子排布为2s22p4,则C为氧元素;A原子外围电子排布为2s22p1或2s22p2,D与A同族,其单质为常用的半导体材料,处于ⅣA族,则A为碳元素、D为Si元素;F原子内层无空轨道,最外层电子数与E相同,则F原子核外电子排布式为1s22s22p63s23p63d104s1,则F为Cu元素,
(1)F为Cu元素,原子核外电子排布式为1s22s22p63s23p63d104s1,Cu价层电子排布为3d104s1;
化合物Cu2O与稀硫酸反应的产物之一为红色固体,且反应中只有Cu元素化合价发生了变化,应生成Cu与硫酸铜,同时生成水,该反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O,
故答案为:3d104s1;Cu2O+2H+=Cu2++Cu+H2O;
(2)A、D的氢化物分别为CH4、SiH4,非金属性C>Si,故稳定性CH4>SiH4,二者都形成分子晶体,SiH4的相对分子质量较大,分子间作用力较强,故SiH4沸点较高,
故答案为:>;<;
(3)氧元素与氢元素形成的正一价离子含有10电子,该离子为H3O+,H3O+中氧原子价层电子对数=3+
=4,O原子含有1对孤对电子,故O原子产生sp3杂化,H3O+的空间构型为三角锥形;
氧元素与氢元素形成的一种18电子分子M的,M为H2O2,则H2O2中O原子价层电子对数=2+
=4,O原子含有2对孤对电子,故O原子产生sp3杂化,H2O2中O原子连接的原子形成V型结构,分子为展开书页形结构,属于极性分子,
故答案为:sp3;三角锥形;极性;
(4)CO2的结构式为O=C=O,1molCO2分子中π键的数目为2NA个;N、O两元素形成的正一价离子N与CO2互为等电子体,则N为NO2+,结构与CO2相似,NO2+的电子式为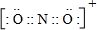 ;
;
故答案为:2NA;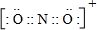 ;
;
(5)由晶胞结构可知,晶胞中CO2分子数目=8×
+6×
=4,晶胞质量=4×
g,最近的两个分子间距离为
acm,则棱长=2
a cm×
=2a cm,故晶胞体积=(2a cm)3=8a3 cm3,则该晶体的密度为=
=
g/cm3,
故答案为:
.
(1)F为Cu元素,原子核外电子排布式为1s22s22p63s23p63d104s1,Cu价层电子排布为3d104s1;
化合物Cu2O与稀硫酸反应的产物之一为红色固体,且反应中只有Cu元素化合价发生了变化,应生成Cu与硫酸铜,同时生成水,该反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O,
故答案为:3d104s1;Cu2O+2H+=Cu2++Cu+H2O;
(2)A、D的氢化物分别为CH4、SiH4,非金属性C>Si,故稳定性CH4>SiH4,二者都形成分子晶体,SiH4的相对分子质量较大,分子间作用力较强,故SiH4沸点较高,
故答案为:>;<;
(3)氧元素与氢元素形成的正一价离子含有10电子,该离子为H3O+,H3O+中氧原子价层电子对数=3+
| 6-1×3-1 |
| 2 |
氧元素与氢元素形成的一种18电子分子M的,M为H2O2,则H2O2中O原子价层电子对数=2+
| 6-1-1 |
| 2 |
故答案为:sp3;三角锥形;极性;
(4)CO2的结构式为O=C=O,1molCO2分子中π键的数目为2NA个;N、O两元素形成的正一价离子N与CO2互为等电子体,则N为NO2+,结构与CO2相似,NO2+的电子式为
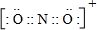 ;
;故答案为:2NA;
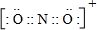 ;
;(5)由晶胞结构可知,晶胞中CO2分子数目=8×
| 1 |
| 8 |
| 1 |
| 2 |
| 44 |
| NA |
| 2 |
| 2 |
| ||
| 2 |
4×
| ||
| 8a3 cm3 |
| 22 |
| NA?a3 |
故答案为:
| 22 |
| NA?a3 |
点评:本题考查物质结构与性质,题目综合性较大,涉及元素推断核外电子排布规律、常用化学用语、化学键、分子结构与性质、晶胞计算等,(4)中注意价电子数相同的等电子体,结构相似,难度中等.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
 【化学--选修3物质结构与性质】
【化学--选修3物质结构与性质】
 该配离子中含有的化学键类型有
该配离子中含有的化学键类型有