摘要:3.二氧化硫和氯气的漂白性 SO2和Cl2虽都有漂白性.但漂白原理和现象有不同特点.氯气的漂白原理是由于溶于水生成次氯酸的具有强氧化性.将有色物质氧化成无色物质.褪色后不能恢复原来的颜色.而SO2是由于它溶于水生成的亚硫酸与有色物质直接结合.形成不稳定的无色化合物.褪色后在一定的条件下又能恢复原来的颜色.如:
网址:http://m.1010jiajiao.com/timu3_id_381038[举报]
(2008?唐山二模)某学生课外活动小组为了证明和比较二氧化硫和氯气的漂白性,设计了如图所示的实验装置.
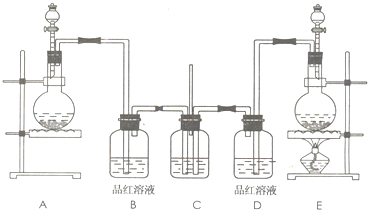
请回答下列问题:
(1)实验室制取氯气的化学方程式为
(2)实验室常用浓硫酸与亚硫酸钠固体反应制取二氧化硫,则其反应装置为上图中的
(3)装置C中试剂的名称及作用是
(4)反应开始后,发现B、D两个装置中的品红溶液都褪色.请设计一个简单实验,证明二氧化硫和氯气漂白品红溶液的原理不同,实验方法、预期的现象和结论为
(5)若将B、D装置中的品红溶液换为滴有酚酞的氢氧化钠溶液,反应一段时间后,B、D中的现象是
(6)实验结束后,经检验,发现装置C中的溶液呈碱性,并且含有SO42-.试写出C中生成的离子方程式(有多种可能,只写出一个即可)
查看习题详情和答案>>

请回答下列问题:
(1)实验室制取氯气的化学方程式为
MnO2+4HCl
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl
MnCl2+Cl2↑+2H2O
.
| ||
(2)实验室常用浓硫酸与亚硫酸钠固体反应制取二氧化硫,则其反应装置为上图中的
A
A
(填写字母代号),不用稀硫酸与亚硫酸钠溶液制取二氧化硫的理由是二氧化硫易溶于水
二氧化硫易溶于水
.(3)装置C中试剂的名称及作用是
氢氧化钠溶液,吸收尾气中的氯气和二氧化硫
氢氧化钠溶液,吸收尾气中的氯气和二氧化硫
.(4)反应开始后,发现B、D两个装置中的品红溶液都褪色.请设计一个简单实验,证明二氧化硫和氯气漂白品红溶液的原理不同,实验方法、预期的现象和结论为
分别取少量褪色后的溶液于试管中,用酒精灯加热,经二氧化硫漂白的品红溶液恢复红色,说明二氧化硫和品红结合成不稳定的物质,经氯气漂白的品红溶液不会变红,说明氯气将品红溶液氧化褪色
分别取少量褪色后的溶液于试管中,用酒精灯加热,经二氧化硫漂白的品红溶液恢复红色,说明二氧化硫和品红结合成不稳定的物质,经氯气漂白的品红溶液不会变红,说明氯气将品红溶液氧化褪色
.(5)若将B、D装置中的品红溶液换为滴有酚酞的氢氧化钠溶液,反应一段时间后,B、D中的现象是
B、D装置的红色都退去
B、D装置的红色都退去
.(6)实验结束后,经检验,发现装置C中的溶液呈碱性,并且含有SO42-.试写出C中生成的离子方程式(有多种可能,只写出一个即可)
Cl2+SO2+4OH-=SO42-+2Cl-+2H2O(或ClO-+SO32-=SO42-+Cl-)
Cl2+SO2+4OH-=SO42-+2Cl-+2H2O(或ClO-+SO32-=SO42-+Cl-)
.下列关于二氧化硫和氯气的说法中,错误的是( )
| A、二氧化硫能漂白某些物质,说明它具有和氯气相同的性质(氧化漂白性) | B、二氧化硫的水溶液能使紫色石蕊变红,说明它能和水反应生成亚硫酸 | C、实验室可用氢氧化钠溶液处理含有二氧化硫和氯气的尾气 | D、将二氧化硫气体通入装有品红溶液的试管中,红色逐渐褪去,给试管加热溶液又变红色 |
下列关于二氧化硫和氯气的说法中,错误的是
A.二氧化硫能漂白某些物质,说明它具有和氯气相同的氧化漂白性
B.二氧化硫的水溶液能使紫色石蕊变红,说明它能和水反应生成亚硫酸
C.实验室可用氢氧化钠溶液处理含有二氧化硫和氯气的尾气
D.将二氧化硫气体通入装有品红溶液的试管中,红色逐渐褪去,给试管加热红色重新出现
查看习题详情和答案>>某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置.
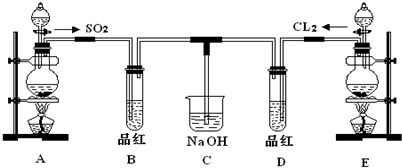
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B:
(2)实验中NaOH溶液的作用是:
查看习题详情和答案>>

(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:
品红褪色
品红褪色
,D:品红褪色
品红褪色
.②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B:
由无色变为红色
由无色变为红色
,D:无明显现象
无明显现象
.(2)实验中NaOH溶液的作用是:
吸收多余的二氧化硫和氯气,防止污染大气
吸收多余的二氧化硫和氯气,防止污染大气
.写出Cl2通入NaOH溶液中的化学方程式Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
. 已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.亚硫酸钠浓硫酸品红的酒精溶液
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处.①
二氧化硫没有干燥(或缺少二氧化硫的干燥装置);
二氧化硫没有干燥(或缺少二氧化硫的干燥装置);
;②没有尾气吸收装置
没有尾气吸收装置
.(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是二氧化硫直接导致.为此,SO2能使品红的水溶液褪色的可能微粒有
H2SO3、HSO3-、SO3 2-
H2SO3、HSO3-、SO3 2-
.(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO3-和SO32-,不是H2SO3.你认为他的结论是否正确
不正确,
不正确,
,其理由是因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸
因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸
.(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,两只烧杯中同时一次性各加入20ml 0.1mol/L的亚硫酸钠,20ml1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快.
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“
①
①
”内容.| 同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面 少 少 |
较上面 多 多 |
较上面 多 多 |
慢 |
使品红褪色的微粒是亚硫酸根离子
使品红褪色的微粒是亚硫酸根离子
.