摘要:不同元素的原子在分子内吸引电子的能力大小可用数值表示.该数值称为电负性.一般认为:如果两个成键元素间的电负性差值大于1.7.原子之间通常形成离子键,如果两个成键元素间的电负性差值小于1.7.通常形成共价键.下表是某些元素的电负性值: 元素符号 Li Be B C O F Na Al Si P S Cl 电负性值 0.98 1.57 2.04 2.55 3.44 3.98 0.93 1.61 1.90 2.19 2.58 3.16 观察上述数据.回答下列问题: (1)通过分析电负性值变化规律.确定Mg元素电负性值的最小范围 . (2)请归纳元素的电负性和金属.非金属的关系是 , (3)某有机化合物结构中含S-N键.其共用电子对偏向 . (4)从电负性角度.判断AlCl3是离子化合物.还是共价化合物的方法是: ,请设计一个实验方案证明上述所得到的结论: . (1)0.93-1.57 (2)非金属性越强.电负性越大.金属性越强.电负性越小 (3)氮原子 (4)Al元素和Cl元素的电负性差值为1.55<1.7.所以形成共价键.为共价化合物, 将氯化铝加热到熔融态.进行导电性实验.如果不导电.说明是共价化合物.
网址:http://m.1010jiajiao.com/timu3_id_379627[举报]
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方.
下面是某些短周期元素的x值;
(1)通过分析x值变化规律,确定N、Mg的x值范围;
(2)推测x值与原子半径的关系是
(3)某有机化合物结构式为C6H5-S-NH2,其中S-N中,你认为共用电子对偏向谁?
(4)经验规律告诉我们:设成键的两原子相应元素的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般共价键,试推断AlBr3中化学键类型是
(5)预测元素周期表中,x值最小的元素位置:
查看习题详情和答案>>
下面是某些短周期元素的x值;
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
0.93
0.93
<x(Mg)<1.57
1.57
,2.55
2.55
<x(N)<3.44
3.44
.(2)推测x值与原子半径的关系是
同周期(同主族)中,x值越大,其原子半径越小
同周期(同主族)中,x值越大,其原子半径越小
;根据短周期元素x值变化特点,体现了元素性质的周期性
周期性
变化规律.(3)某有机化合物结构式为C6H5-S-NH2,其中S-N中,你认为共用电子对偏向谁?
氮原子
氮原子
(写原子名称).(4)经验规律告诉我们:设成键的两原子相应元素的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般共价键,试推断AlBr3中化学键类型是
共价键
共价键
.(5)预测元素周期表中,x值最小的元素位置:
第六周期IA族
第六周期IA族
(放射性元素除外).不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,x越大,其原子吸引电子的能力越强. 下面是某些短周期元素的x值:
(1)通过分析x值变化规律,确定Mg的x值范围:
(2)推测x值与原子半径的关系是
(3)分别指出下列两种化合物中氧元素的化合价:HClO
(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键,试推断AlBr3中化学键类型是
(5)预测元素周期表中,x值最小的元素位于
查看习题详情和答案>>
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
0.93
0.93
<x(Mg)<1.57
1.57
.(2)推测x值与原子半径的关系是
同周期(同主族)中,x值大,其原子半径越小
同周期(同主族)中,x值大,其原子半径越小
;根据短周期元素的x值变化特点,体现了元素性质的周期性
周期性
变化规律.(3)分别指出下列两种化合物中氧元素的化合价:HClO
-2
-2
,HFO0
0
.(4)经验规律告诉我们:当成键的两原子相应元素x数值的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般为共价键,试推断AlBr3中化学键类型是
共价键
共价键
.(5)预测元素周期表中,x值最小的元素位于
第六
第六
周期第IA
第IA
族(放射性元素除外).不同元素的原子在分子内吸引电子的能力大小可用x表示,x越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下面是某些短周期元素的x值.
(1)通过分析x值的变化规律,确定Mg、N的x值范围
Mg:
(2)短周期元素x值的变化特点体现了元素性质的
(3)某有机物分子中含有S-N键,你认为电子对偏向
(4)经验规律告诉我们,当成键的两原子相应元素的x差值△x大于l.7时一般形成离子键,△x小于1.7时一般形成共价键,试预测:AlBr3中化学键的类型是
查看习题详情和答案>>

(1)通过分析x值的变化规律,确定Mg、N的x值范围
Mg:
0.93~1.57
0.93~1.57
、N:2.55~3.44
2.55~3.44
.(2)短周期元素x值的变化特点体现了元素性质的
周期性
周期性
变化规律.(3)某有机物分子中含有S-N键,你认为电子对偏向
N
N
原子(填元素符号).(4)经验规律告诉我们,当成键的两原子相应元素的x差值△x大于l.7时一般形成离子键,△x小于1.7时一般形成共价键,试预测:AlBr3中化学键的类型是
共价键
共价键
.设计实验验证你的预测测定熔融状态下是否导电,若不导电则为共价键.
测定熔融状态下是否导电,若不导电则为共价键.
.不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子能力越强,在形成的化学键中成为带负电荷的一方,下面是某些短周期元素的x值;
(1)推测x值与原子半径的关系是 ;
(2)某有机化合物结构式为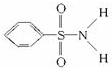 ,其中S-N中,你认为共用电子对偏向 .
,其中S-N中,你认为共用电子对偏向 .
(3)经验规律告诉我们:当成键的两原子相应元素的x差值(△x)即△x>1.7时,一般为离子键,△x<1.7,一般为共价键,试推断:BeCl3中化学键类型是 .
(4)预测元素周期表中x值最小的元素的位置 (放射性元素除外).
查看习题详情和答案>>
| 元素素素素 | Li | Be | B | C | O | F |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
| 元素 | Na | Al | Si | P | S | Cl |
| x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(2)某有机化合物结构式为
 ,其中S-N中,你认为共用电子对偏向
,其中S-N中,你认为共用电子对偏向(3)经验规律告诉我们:当成键的两原子相应元素的x差值(△x)即△x>1.7时,一般为离子键,△x<1.7,一般为共价键,试推断:BeCl3中化学键类型是
(4)预测元素周期表中x值最小的元素的位置
不同元素的原子在分子内吸引电子的能力大小可用数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。
下面是某些短周期元素的x值:
元素符号 | Li | Be | B | C | O | F |
x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 |
元素符号 | Na | Al | Si | P | S | Cl |
x值 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值变化规律,确定Mg、N的x值范围:__________<x(Mg)<__________,__________<x(N)<__________。
(2)推测x值与原子半径的关系是__________,短周期元素x值变化特点,体现了元素性质的__________变化规律。
(3)经验规律告诉我们:当成键的两原子相应元素的差值Δx>1.7时,一般为离子键;当Δx<1.7时,一般为共价键。试推断AlBr3中化学键类型是__________。
(4)预测元素周期表中,x值最小的元素位置:____________________(放射性元素除外)。