网址:http://m.1010jiajiao.com/timu3_id_378935[举报]
目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化成SO42-。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

①其中: 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
②酸性KMnO4溶液体积为200 mL,浓度为0.1 mol·L-1。
回答下列问题:
(1)配制200 mL 0.1 mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有________、________、________、玻璃棒、________、________。玻璃棒的作用是
____________________________________________________________。
(2)写出并配平测定SO2含量的离子方程式:_______________________________________。
(3)实验中棉花的作用是_____________________________________________________;
若要测定空气中可吸入颗粒的含量(g·L-1),还需要测出的数据是________。
(4)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):____________________________________________________。
查看习题详情和答案>>

①其中:
 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。②酸性KMnO4溶液体积为200 mL,浓度为0.1 mol·L-1。
回答下列问题:
(1)配制200 mL 0.1 mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有________、________、________、玻璃棒、________、________。玻璃棒的作用是
____________________________________________________________。
(2)写出并配平测定SO2含量的离子方程式:_______________________________________。
(3)实验中棉花的作用是_____________________________________________________;
若要测定空气中可吸入颗粒的含量(g·L-1),还需要测出的数据是________。
(4)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):____________________________________________________。
中央电视台从2001年6月5日起每天都要报道47个重点城市的空气质量预报。包括SO2和可吸入颗粒的含量。目前测定空气中SO2含量主要用氧化还原反应法。假如给你气体流速管(单位时间内通过气体的体积恒定但无除尘和吸收气体的作用)“¤”、密闭容器“□”、敞口仪器“∪”、导管“-或 、0.0001mol?L-1的酸性高锰酸钾溶液、颗粒吸附剂、品红试液、pH试纸等仪器和药品,请设计一个实验装置,测定你所在地区空气中SO2和可吸入颗粒的含量。已知5SO2+2H2O+2MnO4-(紫色)=5SO42-+2Mn2+(无色)+4H+。环境空气质量标准如下:
、0.0001mol?L-1的酸性高锰酸钾溶液、颗粒吸附剂、品红试液、pH试纸等仪器和药品,请设计一个实验装置,测定你所在地区空气中SO2和可吸入颗粒的含量。已知5SO2+2H2O+2MnO4-(紫色)=5SO42-+2Mn2+(无色)+4H+。环境空气质量标准如下: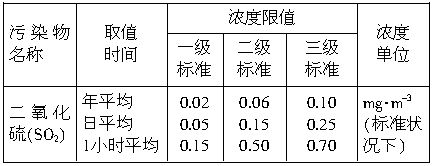
(1)画出测定空气中SO2和可吸入颗粒的含量的实验装置图(并指出仪器中的药品)。
(2)若气体流速管中气体流速为5000cm3?min-1,当140min时20mL0.0001mol?L-1的酸性高锰酸钾溶液恰好退色,则根据我国空气质量标准和测定结果判断所测定地点的空气中SO2的含量属于_________(填数字)级标准(环境)。
(3)若要测定空气中可吸入颗粒的含量,需要测出的数据有__________________________________。
现有药品:0.1mol/L的酸性KMnO4溶液、颗粒吸附剂、品红试纸、pH试纸。
(1)配置250mL0.1mol/L的酸性KMnO4溶液需要用到的仪器有__________________、__________________、玻璃棒、胶头滴管、烧杯等,玻璃棒的作用是________________和________________。
(2)在测定SO2含量和可吸入颗粒的含量时,首先应测定________________,因为__________________________。
(3)写出SO2与酸性KMnO4溶液反应的离子方程式:_________________________________。
(4)若气体的流速为acm3/min,当tmin时,200mL0.1mol/L的酸性KMnO4溶液恰好完全褪色,则空气中的SO2的含量为___________g/cm3。
查看习题详情和答案>>(1)汽车尾气主要含有CO2、CO、SO2、NO及汽油、柴油等物质,这种尾气越来越成为城市空气污染的主要来源。汽车尾气中的CO来自_________,NO来自_________。
(2)空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应。下列有关说法正确的是_________。
A.停止使用氟里昂是为了保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾一淀粉试纸变蓝
(3)一定条件下,2SO2(g)+O2(g)
 2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol
2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K=________。
(4)在一定条件下用氨可将氮氧化物转化为无毒气体。同温同压下,3.5 L NH3恰好将3.0 L NO和NO2的混合气体完全转化为N2,原混合气体中NO和NO2的体积比是_________。
(5)新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能将工业废 气中的酸性氧化物分解除去,转化流程如图所示。若2 mol ZnFe2Ox与SO2反应可生成0.75 mol S,则x=
__________。
