摘要:13.在硫酸溶液中.NaClO3和Na2SO3按物质的量之比为2:1完全反应.生成棕黄色气体X.则X为: A.Cl2 B.Cl2O C.ClO2 D.Cl2O3
网址:http://m.1010jiajiao.com/timu3_id_37892[举报]
有机物A的分子式为C57H104O6,在硫酸存在下发生反应:A+3H2O?3B+C.C分子中含有3个羟基(已知同一个碳原子连接两个羟基的有机物是不稳定的),相对分子质量为92;B与NaOH按物质的量之比1:1混合时恰好完全反应.
(1)A的名称是 ,B的分子式为 ,C的结构简式为 .
(2)已知R-CH=CH-R
R-COOH+R-COOH,B
D+E,等物质的量的D、E分别与足量的NaOH溶液反应时,消耗的NaOH的物质的量之比为1:2,D的相对分子质量比E的少30,且D、E结构中均无支链,则B、E的结构简式分别为 、 (填序号).
(3)某同学对A在碱性条件下的水解及其他性质进行了推断,其中错误的是 (填序号).
a.其他条件相同时,在碱性条件下的水解速率比在硫酸溶液中的快
b.用溴的CCl4溶液可确定A是不饱和油脂
c.A有香味,常温下很可能是固体.
查看习题详情和答案>>
(1)A的名称是
(2)已知R-CH=CH-R
| KMnO4/H+ |
| KMnO4/H+ |
(3)某同学对A在碱性条件下的水解及其他性质进行了推断,其中错误的是
a.其他条件相同时,在碱性条件下的水解速率比在硫酸溶液中的快
b.用溴的CCl4溶液可确定A是不饱和油脂
c.A有香味,常温下很可能是固体.
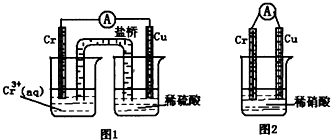
(2012?醴陵市模拟)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢,CrO3大量地用于电镀工业中.
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若在硫酸溶液中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3].则该反应的离子方程式为
(2)存在平衡:2CrO42ˉ(黄色)+2H+?Cr2O72ˉ(橙色)+H2O
①若平衡体系的pH=2,则溶液显
②能说明该反应达平衡状态的是
a.Cr2O72ˉ和CrO42ˉ的浓度相同
b.2V正(Cr2O72ˉ)=V逆(CrO42ˉ)
c.溶液的颜色不变
(3)在图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体.由图1知金属铬的活动性比铜
(4)CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72ˉ发生反应,生成的Fe3+和Cr3+在阴极区与OHˉ结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31].
①电解过程中NaCl的作用是
②已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为:
查看习题详情和答案>>
(1)CrO3具有强氧化性,遇到有机物(如酒精)时,猛烈反应以至着火,若在硫酸溶液中乙醇被氧化成乙酸,CrO3被还原成绿色的硫酸铬[Cr2(SO4)3].则该反应的离子方程式为
4CrO3+3CH3CH2OH+12H+═4Cr3++3CH3COOH+9H2O
4CrO3+3CH3CH2OH+12H+═4Cr3++3CH3COOH+9H2O
.(2)存在平衡:2CrO42ˉ(黄色)+2H+?Cr2O72ˉ(橙色)+H2O
①若平衡体系的pH=2,则溶液显
橙色
橙色
色.②能说明该反应达平衡状态的是
bc
bc
.a.Cr2O72ˉ和CrO42ˉ的浓度相同
b.2V正(Cr2O72ˉ)=V逆(CrO42ˉ)
c.溶液的颜色不变
(3)在图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体.由图1知金属铬的活动性比铜
强
强
(填强,弱),图2装置中铬电极的电极反应式:NO3-+4H++3eˉ=NO↑+2H2O
NO3-+4H++3eˉ=NO↑+2H2O
.
(4)CrO3和K2Cr2O7均易溶于水,这是工业上造成铬污染的主要原因.净化处理方法之一是将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O72ˉ发生反应,生成的Fe3+和Cr3+在阴极区与OHˉ结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KspFe(OH)3=4.0×10-38,KspCr(OH)3=6.0×10-31].
①电解过程中NaCl的作用是
增强溶液的导电性
增强溶液的导电性
.②已知电解后的溶液中c(Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为:
3.0×10ˉ6
3.0×10ˉ6
mol/L.(2013?朝阳区一模)工业上常以赤铁矿石(主要成分为Fe2O3)和焦炭为主要原料,在高温下炼铁.焦炭产生CO的反应是:
C+O2
CO2; C+CO2
2CO
(1)CO还原赤铁矿的化学方程式是
(2)下列说法正确的是
a.为使赤铁矿石充分燃烧,需将其粉碎
b.足量的空气能提高炼铁反应速率
c.与生铁相比较,纯铁转化为“铁水”的温度低
(3)生铁的用途很多,某电镀厂用生铁将废水中的Cr2O72-转化为Cr3+,流程图1:
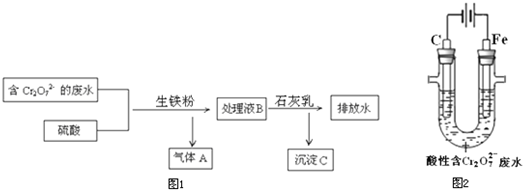
①气体A是
②在上述酸性溶液中,生铁比纯铁产生Fe2+的速率快,原因是
③将Cr3+转化为Cr(OH)3的离子方程式是
(4)电解法将一定浓度的酸性废水中的Cr2O72-转化为Cr3+,其原理示意图2:
①阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式是
②一段时间后,试管底部出现沉淀.解释生成沉淀的原因:
查看习题详情和答案>>
C+O2
| ||
| ||
(1)CO还原赤铁矿的化学方程式是
Fe2O3+3CO
2Fe+3CO2
| ||
Fe2O3+3CO
2Fe+3CO2
| ||
(2)下列说法正确的是
ab
ab
a.为使赤铁矿石充分燃烧,需将其粉碎
b.足量的空气能提高炼铁反应速率
c.与生铁相比较,纯铁转化为“铁水”的温度低
(3)生铁的用途很多,某电镀厂用生铁将废水中的Cr2O72-转化为Cr3+,流程图1:

①气体A是
H2
H2
②在上述酸性溶液中,生铁比纯铁产生Fe2+的速率快,原因是
生铁中含有C,在硫酸溶液中形成无数微小原电池,加快反应速率
生铁中含有C,在硫酸溶液中形成无数微小原电池,加快反应速率
③将Cr3+转化为Cr(OH)3的离子方程式是
2Cr3++3Ca(OH)2═2Cr(OH)3↓+3Ca2+
2Cr3++3Ca(OH)2═2Cr(OH)3↓+3Ca2+
(4)电解法将一定浓度的酸性废水中的Cr2O72-转化为Cr3+,其原理示意图2:
①阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式是
6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O
6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O
②一段时间后,试管底部出现沉淀.解释生成沉淀的原因:
随着电解进行,溶液中c(H+)逐渐减少,c(OH-)浓度增大,生成Fe(OH)3和Cr(OH)3沉淀
随着电解进行,溶液中c(H+)逐渐减少,c(OH-)浓度增大,生成Fe(OH)3和Cr(OH)3沉淀
.(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
①反应速率最大的(即0~1、l~2、2~3、3~4、4~5min)时间段为
②反应速率最小的时间段为
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他的做法可行的是
查看习题详情和答案>>
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
2~3min
2~3min
.原因是该反应为放热反应,此时温度最高
该反应为放热反应,此时温度最高
②反应速率最小的时间段为
4~5min
4~5min
,原因是此时氢离子浓度最小
此时氢离子浓度最小
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入等体积的下列溶液以减慢反应速率
A.蒸馏水 B.CuCl2溶液 C.NaCl溶液
你认为他的做法可行的是
AC
AC
(填相应字母);做法不可行的理由是构成原电池,加快反应速率
构成原电池,加快反应速率
.(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
①反应速率最大的(即0min~1min、1min~2min、2min~3min、3min~4min、4min~5min)时间段为
②反应速率最小的时间段为
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入以下物质用以减缓反应速率
A.蒸馏水 B.更加细小的锌粒 C.NaCl溶液
你认为他的做法可行的是
查看习题详情和答案>>
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
2min~3min
2min~3min
,原因是因该反应是放热反应,此时温度高
因该反应是放热反应,此时温度高
②反应速率最小的时间段为
4min~5min
4min~5min
,原因是:此时H+浓度小
此时H+浓度小
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就事先在硫酸溶液中分别加入以下物质用以减缓反应速率
A.蒸馏水 B.更加细小的锌粒 C.NaCl溶液
你认为他的做法可行的是
A、C
A、C
(填相应字母);做法不可行的理由是:加入更加细小的锌粒,增大接触面积,使反应速率加快
加入更加细小的锌粒,增大接触面积,使反应速率加快
.