摘要:38. 第38题图 如图所示.P为位于某一高度处的质量为m的物块.B为位于水平地板上的质量为M的特殊长平板.m/M=1/10,平板与地面之间的动摩擦因数为μ=0.02.在板的上表面上访.存在一定厚度的“相互作用区域 .如图画虚线的部分.当物块P进入相互作用区时.B便有竖直向上的恒力f作用于P.f=amg.a=51.f对P的作用使P刚好不与B的上表面接触.在水平方向P.B之间没有任何相互作用力.已知物块P从开始下落到刚好到达相互作用区所经历的时间为T0=2.00s.设B板足够长.保证物块P总能落入B板上方的相互作用区.取重力加速度g=9.80m/s2.问 : 当B停止运动时.P已经回到初始位置几次?
网址:http://m.1010jiajiao.com/timu3_id_378871[举报]
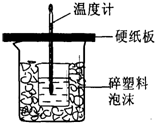
 实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是
Cu传热快,热量损失大
Cu传热快,热量损失大
.(2)在操作正确的前提下,提高中和热测定准确性的关键是:
提高装置的保温效果
提高装置的保温效果
.(3)根据上表中所测数据进行计算,则该实验测得的中和热△H=
-56.8 kJ?mol-1
-56.8 kJ?mol-1
[盐酸和NaOH溶液的密度按1g?cm-3计算,反应后混合溶液的比热容(c)按4.18J?(g?℃)-1计算].如用0.5mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将偏 大
偏 大
(填“偏大”、“偏小”、“不变”).(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
ABDF
ABDF
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大.
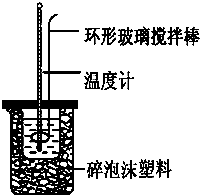 实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题:
实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH,利用如图装置进行中和热的测定,请回答下列问题:(1)不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是
(2)如用0.50mol?L-1盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将
(3)实验得到表中的数据:
| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
[盐酸和NaOH溶液的密度按1g?cm-3计算,反应后混合溶液的比热容(c)按4.18J?(g?℃)-1计算].
 实验室用50mL0.50mol/L盐酸、50mL0.50mol/LNaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL0.50mol/L盐酸、50mL0.50mol/LNaOH溶液和如图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 |
起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
环形玻璃搅拌棒
环形玻璃搅拌棒
;实验时用该仪器搅拌溶液的方法是上下搅动
上下搅动
,由图可知该装置有不妥之处,应如何改正?应使小烧杯口与大烧杯口持平,其余部分用碎塑料填满
应使小烧杯口与大烧杯口持平,其余部分用碎塑料填满
.(2)反应需要多次测量温度,每次测量温度后都必须采取的操作是
用水将温度计上的液体冲掉,并擦干温度计
用水将温度计上的液体冲掉,并擦干温度计
.(3)已知Q=cm△t,经数据处理,则该实验测得的中和热△H=
-56.8kJ/mol
-56.8kJ/mol
(盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(c)按4.18J/(g?℃)计算).
(4)盐酸与氢氧化钠的中和热的文献值为-57.3kJ/mol,你认为(3)中测得的实验值偏差可能的原因是
①量热计的保温瓶绝热效果不好 ②酸碱溶液混合不迅速
①量热计的保温瓶绝热效果不好 ②酸碱溶液混合不迅速
(至少说出两点)(5)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1,则△H1与△H的关系为:△H1
>
>
△H(填“<”、“>”或“=”),理由是NH3?H2O电离吸热
NH3?H2O电离吸热
.废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴、锂.

(1)在上述溶解过程中,S2O32ˉ被氧化成SO42ˉ,LiCoO2在溶解过程中反应的离子方程式为
(2)除杂时通入空气的目的
(3)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如图乙.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阴极的电极反应式是
②b中,生成Li2CO3反应的化学方程式是
查看习题详情和答案>>

(1)在上述溶解过程中,S2O32ˉ被氧化成SO42ˉ,LiCoO2在溶解过程中反应的离子方程式为
S2O32ˉ+8LiCoO2+22H+═2SO42ˉ+8Li++8Co2++11H2O
S2O32ˉ+8LiCoO2+22H+═2SO42ˉ+8Li++8Co2++11H2O
.| 沉淀物 | 开始沉淀pH | 沉淀完全pH |
| Al(OH)3 | 3.0 | 5.2 |
| Fe(OH)3 | 1.5 | 2.8 |
| Fe(OH)2 | 7.6 | 9.7 |
将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
,所得的废渣成分为Fe(OH)3、Al(OH)3
Fe(OH)3、Al(OH)3
.从废渣中获得Al2O3的部分流程如图甲所示,括号表示加入的试剂,方框表示所得到的物质.则步骤I需要的玻璃仪器有烧杯、漏斗、玻璃棒
烧杯、漏斗、玻璃棒
,步骤Ⅱ中反应的离子方程式是2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32ˉ或
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3ˉ
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3ˉ
2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32ˉ或
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3ˉ
.AlO2-+CO2+2H2O═Al(OH)3↓+HCO3ˉ
(3)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如图乙.
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解.
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3.
①a中,阴极的电极反应式是
2H++2e-═H2↑或2H2O+2e-═H2+2OH-
2H++2e-═H2↑或2H2O+2e-═H2+2OH-
.②b中,生成Li2CO3反应的化学方程式是
2LiOH+2NH4HCO3═Li2CO3↓+(NH4)2CO3
2LiOH+2NH4HCO3═Li2CO3↓+(NH4)2CO3
.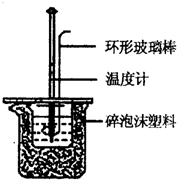 实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol/L盐酸、50mL 0.55mol/L NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
(1)实验时用环形玻璃棒搅拌溶液的方法是
上下搅动
上下搅动
,不能用铜丝搅拌棒代替环形玻璃棒的理由是铜传热快,防止热量损失
铜传热快,防止热量损失
.(2)经数据处理,t2-t1=3.4℃.则该实验测得的中和热△H=
-56.8kJ/mol
-56.8kJ/mol
[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混,合溶液的比热容(c)按4.18J/(g?℃)计算].(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为△H1,则△H1与△H的关系为:△H1
>
>
△H(填“<”、“>”或“=”),理由是NH3?H2O电离吸热
NH3?H2O电离吸热
.