网址:http://m.1010jiajiao.com/timu3_id_378254[举报]
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多l,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀。各物质间的转化关系如下图所示(反应条件多数已略去);
请回答:
(1)反应⑥的离子方程式是
(2)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是
(3)在反应①中,已知lgB,完全燃烧生成液态D时,放出142.9KJ的热量,则表示B燃烧热的热化学方程式是
(4)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是
(5)反应③④在通常情况下不能自发进行,框图中的条件a是 ,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式
查看习题详情和答案>>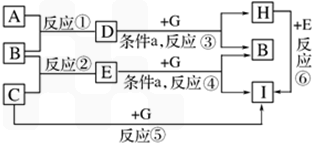
(1) 在反应①中,已知1 g B完全燃烧生成液态D时,放出142.9 kJ的热量,则表示B的燃烧热的热化学方程式是____________________________________________。
(2)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是_______________________________________________。
(3) 反应③④在通常情况下不能自发进行,框图中的条件a是________,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式___________。
(4) 反应⑥的离子方程式是_______________________________________________。
(5) 甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是________。
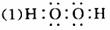
(1)甲、乙两种元素还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式为___________;
(2)实验室制取C的离子反应方程式为_____________;G与D在高温下反应的化学方程式为__________________________.
(3)B在C中燃烧的现象是_____________;在通常状况下,lgB在A中完全燃烧,生成液态D时,放出142.9kJ的热量,则表示B燃烧热的热化学方程式为_____________;
(4)以石墨为电极电解E的水溶液,其阳极反应式为_____________;
(5)实验室检验F的水溶液中所含金属阳离子的操作方法_____________.
查看习题详情和答案>>单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多1,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀,各物质间的转化关系如图所示(反应条件多数已略去):
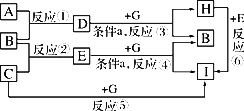
请回答:
(1)在反应①中,已知1 g B完全燃烧生成液态D时,放出142.9 kJ的热量,则表示B的燃烧热的热化学方程式是________.
(2)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是________.
(3)反应③④在通常情况下不能自发进行,框图中的条件a是________,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式________.
(4)反应⑥的离子方程式是________.
(5)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是________.
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多1,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀,各物质间的转化关系如图所示(反应条件多数已略去):

请回答:
(1)反应⑥的离子方程式是________.
(2)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是________.
(3)在反应①中,已知1 g B完全燃烧生成液态D时,放出142.9 kJ的热量,则表示B的燃烧热的热化学方程式是________.
(4)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是________.
(5)反应③④在通常情况下不能自发进行,框图中的条件a是________,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式________.