网址:http://m.1010jiajiao.com/timu3_id_37824[举报]

【1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-】
(1)Pb(NO3)2溶液中,
| c(NO3-) |
| c(Pb2+) |
| c(NO3-) |
| c(Pb2+) |
(2)往Pb(NO3)2溶液中加入NaOH溶液,pH=9时,主要反应的离子方程式为
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验测得铅离子及相关离子浓度变化如下表:
| 离子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg?L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg?L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
(4)如果该脱铅剂(用EH表示)脱铅过程中主要发生的反应为:2EH(s)+Pb2+?E2Pb(s)+2H+,则脱铅的最合适pH范围为
A.4~5 B.6~7 C.9~10 D.11~12.
(1)Pb(NO3)2溶液中,
| c(Pb2+) |
| c(NO3-) |
| 1 |
| 2 |
(2)向Pb(NO3)2溶液中滴加NaOH溶液,溶液变浑浊,在pH约为
(3)水中铅含量检测:
①配制Pb2+浓度为1.0mg/mL的标准溶液100mL.称取
a.容量瓶 b.精确度为0.001g的电子天平 c.精确度为0.1mg的电子天平
②将上述溶液稀释为浓度分别为0.2、1.0、3.0、5.0、7.0、10.0(单位:mg/L)的溶液.稀释时需先加硝酸,然后再加水,这样操作的原因是
③向步骤②配制的各浓度溶液中加入显色剂后,分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下.
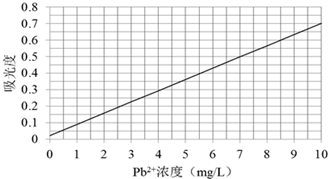
④取某工厂的未经处理的废水水样10mL,稀释至100mL,按步骤③的方法进行测定,两次测定所得的吸光度数据分别为0.490、0.510,则该工厂废水中所含Pb2+浓度为
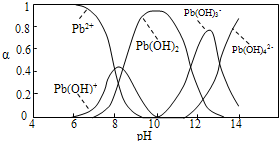
水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、![]() 、
、![]() ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示:

1表示Pb2+,2表示Pb(OH)+,3表示Pb(OH)2,4表示![]() ,5表示
,5表示![]()
(1)Pb(NO3)2溶液中![]() ___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
___________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, ![]() 增大,可能的原因是_____________。
增大,可能的原因是_____________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有___________,pH=9时主要反应的离子方程式为______________。
查看习题详情和答案>>水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH) 、Pb(OH)
、Pb(OH)  ,各形态的浓度分数α随溶液pH变化的关系如下图所示:
,各形态的浓度分数α随溶液pH变化的关系如下图所示: 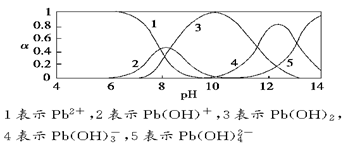
(1)Pb(NO3)2溶液中, ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
| 离 子 | Pb2+ | Ca2+ | Fe3+ | Mn2+ | Cl- |
| 处理前浓度/(mg·L-1) | 0.100 | 29.8 | 0.120 | 0.087 | 51.9 |
| 处理后浓度/(mg·L-1) | 0.004 | 22.6 | 0.040 | 0.053 | 49.8 |
(4)如果该脱铅剂(用EH表示)脱铅过要发生的反应程中主为:2EH(s)+Pb2+
 E2Pb(s)+2H+则脱铅的最合适pH范围为( )
E2Pb(s)+2H+则脱铅的最合适pH范围为( )A.4~5 B.6~7 C.9~10 D.11~12 查看习题详情和答案>>
水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如下图所示:

(1)Pb(NO3)2溶液中, ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
|
离子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
|
处理前浓度/(mg·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
|
处理后浓度/(mg·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是________。
(4)如果 该脱铅剂(用EH表示)脱铅过要发生的反应程中主为:2EH(s)+Pb2+ E2Pb(s)+2H+则脱铅的最合适pH范围为(
)
E2Pb(s)+2H+则脱铅的最合适pH范围为(
)
A.4~5 B.6~7 C.9~10 D.11~12
查看习题详情和答案>>