题目内容
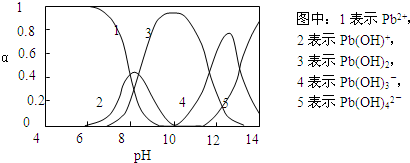
水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-,各形态的浓度分数α随溶液pH变化的关系如下图所示:
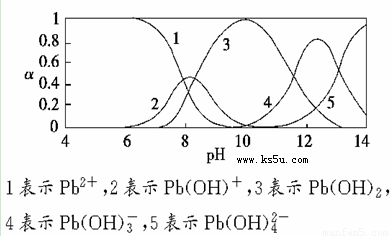
(1)Pb(NO3)2溶液中, ________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后,
________2(填“>”“=”或“<”);往该溶液中滴入氯化铵溶液后, 增加,可能的原因是________________________________。
增加,可能的原因是________________________________。
(2)往Pb(NO3)2溶液中滴入稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有__________,pH=9时主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
|
离子 |
Pb2+ |
Ca2+ |
Fe3+ |
Mn2+ |
Cl- |
|
处理前浓度/(mg·L-1) |
0.100 |
29.8 |
0.120 |
0.087 |
51.9 |
|
处理后浓度/(mg·L-1) |
0.004 |
22.6 |
0.040 |
0.053 |
49.8 |
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是________。
(4)如果 该脱铅剂(用EH表示)脱铅过要发生的反应程中主为:2EH(s)+Pb2+ E2Pb(s)+2H+则脱铅的最合适pH范围为(
)
E2Pb(s)+2H+则脱铅的最合适pH范围为(
)
A.4~5 B.6~7 C.9~10 D.11~12
(1)> Pb2+与Cl-反应,Pb2+浓度减少
(2)Pb2+、Pb(OH)+、H+ Pb(OH)++OH- Pb(OH)2
Pb(OH)2
(3)Fe3+ (4)B
【解析】
试题分析:(1)因为Pb(NO3)2是一种强酸弱碱盐,在水溶液中存在如下水解平衡:2H2O+Pb2+ Pb(OH)2+2H+,使c(Pb2+)减小,所以
Pb(OH)2+2H+,使c(Pb2+)减小,所以 ;滴入氯化铵溶液后,Pb2+与Cl‾反应生成难溶的PbCl2,所以Pb2+浓度减少。
;滴入氯化铵溶液后,Pb2+与Cl‾反应生成难溶的PbCl2,所以Pb2+浓度减少。
(2)pH=8时,曲线上1、2、3表示的物质共存,所以此时溶液中存在的阳离子(Na+除外)有Pb2+、Pb(OH)+和H+。pH=9时,曲线2、3表示的物质共存,由图可知Pb(OH)2的浓度分数比Pb(OH)+的大,所以主要反应是生成Pb(OH)2,离子方程式为:Pb(OH)++OH- Pb(OH)2。
Pb(OH)2。
(3)分析比较表中所给数据可知Cu2+、Mn2+、Cl-的浓度都降低不到原浓度的1/2,而Fe3+却降低为原浓度的1/3,故对Fe3+的去除效果最好。
(4)由所给平衡可知,要使脱铅效果好,铅应以Pb2+的形式存在,pH<7,而c(H+)增大时2EH(s)+Pb2+ E2Pb(s)+2H+又会向逆反应方向移动,c(H+)不宜过大,所以脱铅最适宜的pH为6~7。
E2Pb(s)+2H+又会向逆反应方向移动,c(H+)不宜过大,所以脱铅最适宜的pH为6~7。
考点:本题考查盐类的水解、离子及其浓度的判断、离子方程式的书写、试剂的选择。

Ⅰ.氮是地球上含量丰富的一种元 素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
素,氮及其化合物在工农业生产、生活中有着重要作用。请回答: (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g) 2NH3(g)
其化学平衡常数K与温度t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol·L-1)2 | 4.1×106 | K1 | K2 | … |
 下列问题:
下列问题:①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式 。[来源:Z_xx_k.Com]
②盐酸肼水溶液中离子浓
 度的排列顺序正确的是 (填序号)。
度的排列顺序正确的是 (填序号)。A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-)
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
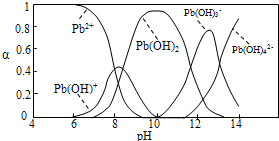
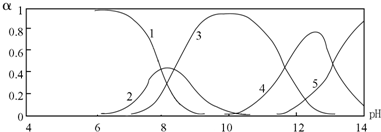
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
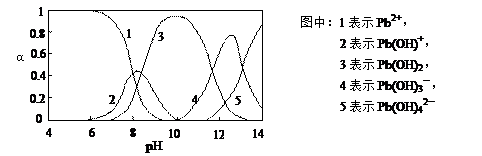 |
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-) 1/2(填“>”、“=”、“<”)。
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为 。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为 时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为:
 。
。 
 2NH3(g)
2NH3(g)