摘要:崇5.下列物质分离过程中涉及共价键断裂的是 A.用渗析法除去淀粉胶体中的少量NaCl B.用饱和食盐水洗去Cl2中的少量HCl C.用CCl4萃取碘水中的碘 D.用升华法除去NaCl中混有的少量碘
网址:http://m.1010jiajiao.com/timu3_id_378028[举报]
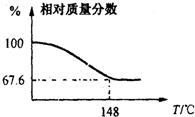 (2012?信阳一模)Na2CO3和H2O2结合成棒状晶体Na2CO3?xH2O2(过氧化氢相当于水合.Na2CO3?xH2O2同时具有Na2CO3和H2O2的性质.注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源.现称取一定质量的Na2CO3?xH2O2晶体加热.实验结果以温度和残留固体的相对质量分数示如图.
(2012?信阳一模)Na2CO3和H2O2结合成棒状晶体Na2CO3?xH2O2(过氧化氢相当于水合.Na2CO3?xH2O2同时具有Na2CO3和H2O2的性质.注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源.现称取一定质量的Na2CO3?xH2O2晶体加热.实验结果以温度和残留固体的相对质量分数示如图.(1)该棒状晶体的化学式Na2CO3?xH2O2中x=
1.5
1.5
.(2)加热过程中,在141℃时表现为放热,其原因可能是:
a.Na2CO3?xH2O2分解放热
b.产生的H2O2分解放热
C.Na2CO3?xH2O2分解吸收热量小于产生的H2O2分解放出的热量
(3)事实上,Na2CO3?H2O2(x=1时)是Na2CO4?H2O(Na2CO4叫做过氧碳酸钠).洗衣粉中加入适量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒.试用化学方程式表示上述洗涤原理:
2Na2CO4═2Na2CO3+O2↑
2Na2CO4═2Na2CO3+O2↑
.(4)写出Na2CO4溶液与稀硫酸反应的离子方程式
2CO42-+4H+═O2↑+2CO2↑+2H2O
2CO42-+4H+═O2↑+2CO2↑+2H2O
.(5)下列物质不会使过碳酸钠失效的是
D
D
.A.MnO2 B.H2S C.CH3COOH D.NaHCO3
(6)Na2O2、K2O2、CaO2以及BaO2都可与酶作用生成过氧化氢,目前实验室制取过氧化氢的水溶液可通过上述某种过氧化物与适量稀硫酸作用,最适合的过氧化物是
BaO2
BaO2
;原因是生成过氧化氢和硫酸钡沉淀,滤去沉淀即得到较为纯净的过氧化氢溶液
生成过氧化氢和硫酸钡沉淀,滤去沉淀即得到较为纯净的过氧化氢溶液
.要使获得的过氧化氢从其水溶液中分离出来,采取的措施是减压蒸馏
减压蒸馏
.(16分)Na2CO3和H2O2结合成棒状晶体,Na2CO3·xH2O2(过氧化氢合相当于水合。注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源…。
现称取一定质量的Na2CO3·xH2O2晶体加热。实验结果以温度和相对质量分数示于下图。
(1)该棒状晶体的化学式Na2CO3·xH2O2中x= 。
(2)加热过程中,在141℃时表现为放热,其原因可能是:
a. Na2CO3·xH2O2分解放热
b.产生的H2O2分解放热
c. Na2CO3·xH2O2分解吸收热量小于产生的H2O2分解放出的热量
(3)事实上,Na2CO3·H2O2(x=1时)是Na2CO4·H2O(Na2CO4叫做过氧碳酸钠)。洗衣粉中加入适 量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理: 。
量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理: 。
(4)写出Na2CO4溶液与稀硫酸反应的离子方程式 。
(5)下列物质不会使过碳酸钠失效的是
| A.MnO2 | B.H2S | C.CH3COOH | D.NaHCO3 |
 。
查看习题详情和答案>>
。
查看习题详情和答案>>
Na2CO3和H2O2结合成棒状晶体,Na2CO3·xH2O2(过氧化氢合相当于水合。注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源…。现称取一定质量的Na2CO3·xH2O2晶体加热。实验结果以温度和相对质量分数示于下图。

(1)该棒状晶体的化学式Na2CO3·xH2O2中x=_____________。
(2)加热过程中,在141℃时表现为放热,其原因可能是:_______________
a. Na2CO3·xH2O2分解放热
b. 产生的H2O2分解放热
c. Na2CO3·xH2O2分解吸收热量小于产生的H2O2分解放出的热量
(3)事实上,Na2CO3·H2O2(x=1时)是Na2CO4·H2O(Na2CO4叫做过氧碳酸钠)。洗衣粉中加入适量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理______________________。
(4)写出Na2CO4溶液与稀硫酸反应的离子方程式__________________。
(5)下列物质不会使过碳酸钠失效的是_____________
A、 MnO2 B、H2S C、CH3COOH D、NaHCO3
(6)Na2O2、K2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢的水溶液可通过上述某种过氧化物与适量稀硫酸作用,最适合的过氧化物是___________,原因是_______________。要使获得的过氧化氢从其水溶液中分离出来,采取的措施是___________________ 。
(7)写出过氧酸根的等电子体____________________(一到二种)
查看习题详情和答案>>
(2)加热过程中,在141℃时表现为放热,其原因可能是:_______________
a. Na2CO3·xH2O2分解放热
b. 产生的H2O2分解放热
c. Na2CO3·xH2O2分解吸收热量小于产生的H2O2分解放出的热量
(3)事实上,Na2CO3·H2O2(x=1时)是Na2CO4·H2O(Na2CO4叫做过氧碳酸钠)。洗衣粉中加入适量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒。试用化学方程式表示上述洗涤原理______________________。
(4)写出Na2CO4溶液与稀硫酸反应的离子方程式__________________。
(5)下列物质不会使过碳酸钠失效的是_____________
A、 MnO2 B、H2S C、CH3COOH D、NaHCO3
(6)Na2O2、K2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢的水溶液可通过上述某种过氧化物与适量稀硫酸作用,最适合的过氧化物是___________,原因是_______________。要使获得的过氧化氢从其水溶液中分离出来,采取的措施是___________________ 。
(7)写出过氧酸根的等电子体____________________(一到二种)
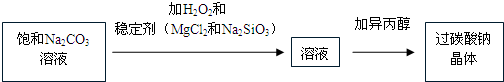
(2012?浙江模拟)过碳酸钠(2Na2CO3?3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂.某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:

 已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)
已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)  2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)
△H<0
副反应 2H2O2=2H2O+O2↑
滴定反应 6KMnO4+5(2Na2CO3?3H2O2)+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O
50°C时 2Na2CO3?3H2O2 (s) 开始分解
请回答下列问题:
(1)图中支管的作用是
(2)步骤①的关键是控制温度,其措施有
(3)在滤液X中加入适量NaCl固体或无水乙醇,均可析出过碳酸钠,原因是
(4)步骤③中选用无水乙醇洗涤产品的目的是
(5)下列物质中,会引起过碳酸钠分解的有
A.Fe2O3 B.CuO
C.Na2SiO3 D.MgSO4
(6)准确称取0.2000g 过碳酸钠于250mL 锥形瓶中,加50mL 蒸馏水溶解,再加50mL 2.0mol?L-1 H2SO4,用2.000×10-2 mol?L-1 KMnO4 标准溶液滴定至终点时消耗30.00mL,则产品中H2O2的质量分数为
查看习题详情和答案>>

 已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)
已知:主反应 2Na2CO3 (aq)+3H2O2 (aq)  2Na2CO3?3H2O2 (s)
2Na2CO3?3H2O2 (s)△H<0
副反应 2H2O2=2H2O+O2↑
滴定反应 6KMnO4+5(2Na2CO3?3H2O2)+19H2SO4=3K2SO4+6MnSO4+10Na2SO4+10CO2↑+15O2↑+34H2O
50°C时 2Na2CO3?3H2O2 (s) 开始分解
请回答下列问题:
(1)图中支管的作用是
平衡压强
平衡压强
.(2)步骤①的关键是控制温度,其措施有
冷水浴
冷水浴
、磁力搅拌
磁力搅拌
和缓慢滴加H2O2溶液
缓慢滴加H2O2溶液
.(3)在滤液X中加入适量NaCl固体或无水乙醇,均可析出过碳酸钠,原因是
降低产品的溶解度(盐析作用或醇析作用)
降低产品的溶解度(盐析作用或醇析作用)
.(4)步骤③中选用无水乙醇洗涤产品的目的是
洗去水份,利于干燥
洗去水份,利于干燥
.(5)下列物质中,会引起过碳酸钠分解的有
AB
AB
.A.Fe2O3 B.CuO
C.Na2SiO3 D.MgSO4
(6)准确称取0.2000g 过碳酸钠于250mL 锥形瓶中,加50mL 蒸馏水溶解,再加50mL 2.0mol?L-1 H2SO4,用2.000×10-2 mol?L-1 KMnO4 标准溶液滴定至终点时消耗30.00mL,则产品中H2O2的质量分数为
0.2550
0.2550
.