题目内容
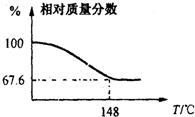 (2012?信阳一模)Na2CO3和H2O2结合成棒状晶体Na2CO3?xH2O2(过氧化氢相当于水合.Na2CO3?xH2O2同时具有Na2CO3和H2O2的性质.注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源.现称取一定质量的Na2CO3?xH2O2晶体加热.实验结果以温度和残留固体的相对质量分数示如图.
(2012?信阳一模)Na2CO3和H2O2结合成棒状晶体Na2CO3?xH2O2(过氧化氢相当于水合.Na2CO3?xH2O2同时具有Na2CO3和H2O2的性质.注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源.现称取一定质量的Na2CO3?xH2O2晶体加热.实验结果以温度和残留固体的相对质量分数示如图.(1)该棒状晶体的化学式Na2CO3?xH2O2中x=
1.5
1.5
.(2)加热过程中,在141℃时表现为放热,其原因可能是:
a.Na2CO3?xH2O2分解放热
b.产生的H2O2分解放热
C.Na2CO3?xH2O2分解吸收热量小于产生的H2O2分解放出的热量
(3)事实上,Na2CO3?H2O2(x=1时)是Na2CO4?H2O(Na2CO4叫做过氧碳酸钠).洗衣粉中加入适量的Na2CO4可以提高洗涤质量,其目的是对衣物进行漂白、消毒.试用化学方程式表示上述洗涤原理:
2Na2CO4═2Na2CO3+O2↑
2Na2CO4═2Na2CO3+O2↑
.(4)写出Na2CO4溶液与稀硫酸反应的离子方程式
2CO42-+4H+═O2↑+2CO2↑+2H2O
2CO42-+4H+═O2↑+2CO2↑+2H2O
.(5)下列物质不会使过碳酸钠失效的是
D
D
.A.MnO2 B.H2S C.CH3COOH D.NaHCO3
(6)Na2O2、K2O2、CaO2以及BaO2都可与酶作用生成过氧化氢,目前实验室制取过氧化氢的水溶液可通过上述某种过氧化物与适量稀硫酸作用,最适合的过氧化物是
BaO2
BaO2
;原因是生成过氧化氢和硫酸钡沉淀,滤去沉淀即得到较为纯净的过氧化氢溶液
生成过氧化氢和硫酸钡沉淀,滤去沉淀即得到较为纯净的过氧化氢溶液
.要使获得的过氧化氢从其水溶液中分离出来,采取的措施是减压蒸馏
减压蒸馏
.分析:(1)根据固体质量差量法来计算x的值;
(2)加热过程中,结晶水合物失去结晶水的过程是吸热的,但是双氧水分解放出的热量;
(3)过氧碳酸钠不稳定,易分解为碳酸钠和氧气;
(4)Na2CO4溶液与稀硫酸反应生成硫酸钠、水、二氧化碳以及氧气;
(5)根据物质的性质来分析判断;
(6)根据物质和水之间反应所得产物是否容易分离来回答.
(2)加热过程中,结晶水合物失去结晶水的过程是吸热的,但是双氧水分解放出的热量;
(3)过氧碳酸钠不稳定,易分解为碳酸钠和氧气;
(4)Na2CO4溶液与稀硫酸反应生成硫酸钠、水、二氧化碳以及氧气;
(5)根据物质的性质来分析判断;
(6)根据物质和水之间反应所得产物是否容易分离来回答.
解答:解:(1)2Na2CO3?xH2O2
2Na2CO3+xO2↑+2xH2O,根据温度和残留固体的相对质量分数示意图,当温度为148℃时,所的固体只有碳酸钠,质量分数为67.6%,所以固体质量减少的百分数为
×100%=1-67.6%,解得x=1.5,
故答案为:1.5;
(2)加热过程中,结晶水合物失去结晶水的过程是吸热的,在141℃时表现为放热,则双氧水分解放出的热量会高于晶体分解吸收的热量,
故答案为:C;
(3)过氧碳酸钠不稳定,易分解为碳酸钠和氧气,2Na2CO4═2Na2CO3+O2↑,所以洗衣粉中加入适量的Na2CO4可以提高洗涤质量,
故答案为:2Na2CO4═2Na2CO3+O2↑;
(4)Na2CO4溶液与稀硫酸反应生成硫酸钠、水、二氧化碳以及氧气,反应的离子方程式为:2CO42-+4H+═O2↑+2CO2↑+2H2O,
故答案为:2CO42-+4H+═O2↑+2CO2↑+2H2O;
(5)Na2CO3?xH2O2同时具有Na2CO3和H2O2的性质,只要选项中的物质和碳酸钠以及双氧水反应即可.
A.MnO2会使双氧水分解,所以会使过碳酸钠失效,故A错误;
B.H2S能和双氧水之间反应,所以会使过碳酸钠失效,故B错误;
C.CH3COOH能和碳酸钠之间反应,所以会使过碳酸钠失效,故C错误;
D.NaHCO3和碳酸钠以及双氧水均不会反应,不会使过碳酸钠失效,故D正确.
故选:D.
(6)过氧化钡和水之间反应生成过氧化氢和硫酸钡沉淀,滤去沉淀即得到较为纯净的过氧化氢溶液,而Na2O2、K2O2、CaO2和水之间反应生成过氧化氢和一种易溶于水的溶液,无法获得双氧水,分离双氧水中的过氧化氢和水,可以采用减压蒸馏的方法,
故答案为:BaO2;生成过氧化氢和硫酸钡沉淀,滤去沉淀即得到较为纯净的过氧化氢溶液;减压蒸馏.
| ||
| 68x |
| 212+68x |
故答案为:1.5;
(2)加热过程中,结晶水合物失去结晶水的过程是吸热的,在141℃时表现为放热,则双氧水分解放出的热量会高于晶体分解吸收的热量,
故答案为:C;
(3)过氧碳酸钠不稳定,易分解为碳酸钠和氧气,2Na2CO4═2Na2CO3+O2↑,所以洗衣粉中加入适量的Na2CO4可以提高洗涤质量,
故答案为:2Na2CO4═2Na2CO3+O2↑;
(4)Na2CO4溶液与稀硫酸反应生成硫酸钠、水、二氧化碳以及氧气,反应的离子方程式为:2CO42-+4H+═O2↑+2CO2↑+2H2O,
故答案为:2CO42-+4H+═O2↑+2CO2↑+2H2O;
(5)Na2CO3?xH2O2同时具有Na2CO3和H2O2的性质,只要选项中的物质和碳酸钠以及双氧水反应即可.
A.MnO2会使双氧水分解,所以会使过碳酸钠失效,故A错误;
B.H2S能和双氧水之间反应,所以会使过碳酸钠失效,故B错误;
C.CH3COOH能和碳酸钠之间反应,所以会使过碳酸钠失效,故C错误;
D.NaHCO3和碳酸钠以及双氧水均不会反应,不会使过碳酸钠失效,故D正确.
故选:D.
(6)过氧化钡和水之间反应生成过氧化氢和硫酸钡沉淀,滤去沉淀即得到较为纯净的过氧化氢溶液,而Na2O2、K2O2、CaO2和水之间反应生成过氧化氢和一种易溶于水的溶液,无法获得双氧水,分离双氧水中的过氧化氢和水,可以采用减压蒸馏的方法,
故答案为:BaO2;生成过氧化氢和硫酸钡沉淀,滤去沉淀即得到较为纯净的过氧化氢溶液;减压蒸馏.
点评:本题是一道综合考查学生金属钠以及化合物性质的题目,要求学生具有分析和解决问题的能力,难度大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目