摘要:东7.反应⑴.⑵分别是从海藻灰和智利硝石中提取碘的主要反应: 2 NaI + MnO2 + 3 H2SO4 = 2 NaHSO4 + MnSO4+2 H2O + I2 ---⑴ 2 NaIO3 + 5 NaHSO3 = 2 Na2SO4 + 3 NaHSO4 + H2O + I2 ---⑵ 下列说法正确的是 A.两个反应中NaHSO4均为氧化产物 B.I2在反应⑴中是还原产物.在反应⑵中是氧化产物 C.氧化性:MnO2>SO42->IO3->I2 D.反应中生成等量的I2时转移电子数之比为1:5 4丰8.一定能在下列无色溶液中大量共存的离子组是 A.c(H+)=1×10-13mol·L-1的溶液:Na+.Ba2+.HCO3-.SO42- B.在pH=1的溶液中:K+.Fe2+.Cl-.NO3- C.在能使紫色的石蕊试液变红的溶液中:Na+.NH4+.SO42-.Cl- D.加入铝单质能产生大量氢气的溶液:Na+.NO3-.SO42-.Cl-
网址:http://m.1010jiajiao.com/timu3_id_378006[举报]
(2012?河东区一模)现以乙醛为原料,发生以下的反应(A、B、C、D、E、F均为有机物):根据下列已知条件回答问题:
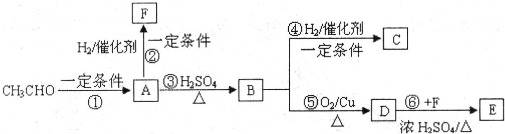
己知:
①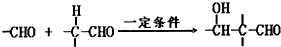
②E的分子式C12H18O4;B中无甲基;
(1)A的分子式为:
对有机物B化学性质的叙述错误的是
A.既能发生氧化反应又能发生还原反应
B.与H2发生加成反应,必定得到一种纯的新有机物
C.能发生加聚反应生成高聚物
D.能使Br2的水溶液褪色,1mol该有机物恰好和1mol Br2反应
(2)③和④的反应类型分别为:③
(3)请写出①的化学反应方程式:
(4)请写出⑥的化学反应方程式:
(5)请用系统命名法给F命名:
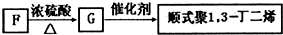
写出G→顺式聚1,3-丁二烯的化学反应方程式:
(6)7.4g C与足量金属Na反应,产生H2
(7)A有许多种同分异构体,请写出所有符合下列条件的A的同分异构体:
①能够发生水解反应;②能够发生银镜反应;③非醚类物质
查看习题详情和答案>>

己知:
①
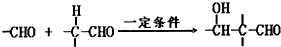
②E的分子式C12H18O4;B中无甲基;
(1)A的分子式为:
C4H8O2
C4H8O2
,B的结构简式为:CH2=CHCH2CHO
CH2=CHCH2CHO
;对有机物B化学性质的叙述错误的是
BD
BD
A.既能发生氧化反应又能发生还原反应
B.与H2发生加成反应,必定得到一种纯的新有机物
C.能发生加聚反应生成高聚物
D.能使Br2的水溶液褪色,1mol该有机物恰好和1mol Br2反应
(2)③和④的反应类型分别为:③
消去反应
消去反应
④加成反应或还原反应
加成反应或还原反应
:(3)请写出①的化学反应方程式:
2CH3CHO
CH3CH(OH)CH2CHO
| 一定条件 |
2CH3CHO
CH3CH(OH)CH2CHO
;| 一定条件 |
(4)请写出⑥的化学反应方程式:
CH3CH(OH)CH2CH2OH+2CH2=CHCH2COOH
2H2O+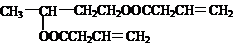
| 浓H2SO4 |
| △ |
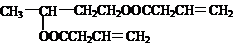
CH3CH(OH)CH2CH2OH+2CH2=CHCH2COOH
2H2O+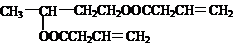
;| 浓H2SO4 |
| △ |
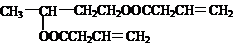
(5)请用系统命名法给F命名:
1,3-丁二醇
1,3-丁二醇
,F还能用于合成下列高聚物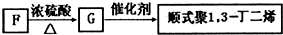
写出G→顺式聚1,3-丁二烯的化学反应方程式:
nCH2=CH-CH=CH2
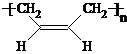
| 催化剂 |
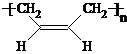
nCH2=CH-CH=CH2
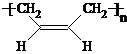
;| 催化剂 |
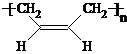
(6)7.4g C与足量金属Na反应,产生H2
1.12
1.12
L(标准状况下).(7)A有许多种同分异构体,请写出所有符合下列条件的A的同分异构体:
①能够发生水解反应;②能够发生银镜反应;③非醚类物质
HCOOCH2CH2CH3、HCOOCH(CH3)2
HCOOCH2CH2CH3、HCOOCH(CH3)2
.(1)己知:Fe(s)+
O2(g)=FeO(s)△H=-272.0kJ?mol-1
2Al(s)+
O2(g)=Al2O3(s)△H=-1675.7kJ?mol-1
Al和FeO发生铝热反应的热化学方程式是
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
①据图判断该反应是
②其中B历程表明此反应采用的条件为
A.升高温度
B.增大反应物的浓度
C.降低温度
D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:
Na2SO4(S)+4H2(g)═Na2S(s)+4H2O(g)
该反应的平衡常数表达式为
;
已知K1000℃<K1200℃,若降低体系温度,混合气体的平均相对分子质量将
(4)常温下;如果取0.1mol?L-1 HA溶液与0.1mol?L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8.
①混合液中由水电离出的OH-浓度与0.1mol?L-1 NaOH溶液中由水电离出的OH-浓度之比为
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH
相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.
查看习题详情和答案>>
| 1 |
| 2 |
2Al(s)+
| 3 |
| 2 |
Al和FeO发生铝热反应的热化学方程式是
2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1
2Al(s)+3FeO(s)═Al2O3(s)+3Fe(s)△H=-859.7 kJ?mol-1
.
(2)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
①据图判断该反应是
烯
烯
(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率减小
减小
(填“增大”、“减小”或“不变”);②其中B历程表明此反应采用的条件为
D
D
.(选填序号).A.升高温度
B.增大反应物的浓度
C.降低温度
D.使用催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:
Na2SO4(S)+4H2(g)═Na2S(s)+4H2O(g)
该反应的平衡常数表达式为
| c4(H2O) |
| c4(H2) |
| c4(H2O) |
| c4(H2) |
已知K1000℃<K1200℃,若降低体系温度,混合气体的平均相对分子质量将
增大
增大
(填“增大”、“减小”或“不变”).(4)常温下;如果取0.1mol?L-1 HA溶液与0.1mol?L-1 NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8.
①混合液中由水电离出的OH-浓度与0.1mol?L-1 NaOH溶液中由水电离出的OH-浓度之比为
107:1
107:1
;②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH
>
>
7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为
c>a>b>d
c>a>b>d
(填序号)a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl.
(2012?石景山区一模)某校两个班的化学研究性学习小组,在学习了铜和浓硫酸的反应后分别探究足量的锌与浓硫酸反应的过程.一班小组设计了下图装置:

试回答:
(1)请从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接
(2)D、E两支试管中CCl4的作用是
(3)本实验能证明浓硫酸具有强氧化性的实验现象为
(4)D中出现浑浊的离子方程式为
(5)某学生注意观察到:实验开始后,C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中出现浑浊;反应一段时间后,C、D、E中的气泡量又会明显增加.请用化学方程式表示“反应一段时间后气泡量又会明显增加”的原因是
二班小组设计了下图装置:

(6)分析出二班小组的设计意图是
(7)装置B中的药品是
(8)能证明产生SO2和H2先后顺序的实验现象是
查看习题详情和答案>>

试回答:
(1)请从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接
3(或4),4(或3)接b,
3(或4),4(或3)接b,
c接2,1
c接2,1
接d(用序号表示).(2)D、E两支试管中CCl4的作用是
防倒吸
防倒吸
.(3)本实验能证明浓硫酸具有强氧化性的实验现象为
C中品红溶液褪色
C中品红溶液褪色
.(4)D中出现浑浊的离子方程式为
Ca2++2OH-+SO2═CaSO3↓+H2O
Ca2++2OH-+SO2═CaSO3↓+H2O
.(5)某学生注意观察到:实验开始后,C、D、E中均有气泡产生;随后气泡量减少,品红溶液褪色,D中出现浑浊;反应一段时间后,C、D、E中的气泡量又会明显增加.请用化学方程式表示“反应一段时间后气泡量又会明显增加”的原因是
Zn+H2SO4(稀)═ZnSO4+H2↑
Zn+H2SO4(稀)═ZnSO4+H2↑
.二班小组设计了下图装置:

(6)分析出二班小组的设计意图是
验证产物中先产生水、SO2,后产生H2
验证产物中先产生水、SO2,后产生H2
.(7)装置B中的药品是
无水CuSO4
无水CuSO4
.(8)能证明产生SO2和H2先后顺序的实验现象是
C中品红褪色,D中酸性高锰酸钾不再褪色后,F中有红色物质生成,G中无水硫酸铜变蓝
C中品红褪色,D中酸性高锰酸钾不再褪色后,F中有红色物质生成,G中无水硫酸铜变蓝
.下表为第2、3周期某些元素性质的数据.
请回答下列问题:
(1)③在周期表中的位置
(2)⑤元素最高价氧化物对应的水化物的名称
(3)由①⑤⑥三种元素组成一种化合物是家用消毒液的主要成分,其溶液显
(4)用化学方程式举例⑤元素的单质一种用途:
(5)已知⑥和①的单质在常温和加热时都能反应,分别生成化合物甲和乙,同时若1mol⑥参加反应分别放出aKJ和bKJ热量.请写出由甲转化为乙的热化学方程式:
(6)②和⑦组成的化合物含有的化学键为
(7)在家用电热水器不锈钢内胆表面经常镶嵌②的单质,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:
查看习题详情和答案>>
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径/10-10m | 0.73 | 1.36 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.02 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | |||
| -2 | -3 | -2 |
(1)③在周期表中的位置
第二周期,ⅠA族
第二周期,ⅠA族
.(2)⑤元素最高价氧化物对应的水化物的名称
高氯酸
高氯酸
.(3)由①⑤⑥三种元素组成一种化合物是家用消毒液的主要成分,其溶液显
碱
碱
性(填酸或碱),原因可用离子方程式表示:ClO-+H2O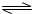 HClO+OH-
HClO+OH-
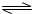 HClO+OH-
HClO+OH-ClO-+H2O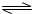 HClO+OH-
HClO+OH-
.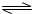 HClO+OH-
HClO+OH-(4)用化学方程式举例⑤元素的单质一种用途:
Cl2+H2═2HCl
Cl2+H2═2HCl
.(5)已知⑥和①的单质在常温和加热时都能反应,分别生成化合物甲和乙,同时若1mol⑥参加反应分别放出aKJ和bKJ热量.请写出由甲转化为乙的热化学方程式:
2Na2O(S)+O2(g)═2Na2O2(s)△H=-(4b-4a)KJ?mol-1
2Na2O(S)+O2(g)═2Na2O2(s)△H=-(4b-4a)KJ?mol-1
(6)②和⑦组成的化合物含有的化学键为
离子键
离子键
.(7)在家用电热水器不锈钢内胆表面经常镶嵌②的单质,利用电化学原理来防止内胆腐蚀,写出正极的电极反应式:
O2+4e-+2H2O═4OH-
O2+4e-+2H2O═4OH-
.