摘要:鸦片 鸦片是罂粟未成熟的果实用刀割后流出的汁液.经加工而成的褐色膏状物又称生鸦片.生鸦片中除了百分之十五至三十的矿物质.树脂和水分外.还含有百分之十至二十的特殊生物碱.这些生物碱可分为吗啡类生物碱.罂粟碱类生物碱.盐酸那可汀类生物碱三大类. 例题1:鸦片是一种容易上瘾的毒品.其毒性主要是来自下列哪一个化合物 安非他命 尼古丁 解析:(A)海洛因:化学结构类似吗啡.属白色晶体纯度较吗啡高.比吗啡更易上瘾.属于植物碱.(B)安非他命:白色.无臭有苦味晶体.沸点为320℃,化学式为:C9H13N.(C)鸦片中含有20多种植物碱.其毒性主要由吗啡所造成.(D)尼古丁的分子式为:C10H14N2.尼古丁是一种兴奋剂.刺激肾上腺素.使心跳加速血压上升.答案(C). 摇头丸 “摇头丸 是一种新的毒品--“冰 毒衍生物二亚甲基双氧苯丙胺和亚甲氧基苯丙胺(MDA)的俗称. 例题2:一种称为"摇头丸"的毒品已从国.外流入我国.严重损害一些吸毒者的身心健康.司法机关予以坚决查缉和打击.已知该毒品中氮的质量分数为10.37%.试回答: 1.①"摇头丸"的分子结构可能是( )3 A. B. C. D. ②据①中“摇头丸 的分子结构分析.处于同一平面上的碳原子至少有( ) A.6个 B.7个 C.8个 D.9个 ③固体“摇头丸 属于( ) A.分子晶体 B.原子晶体 C.离子晶体 D.金属晶体 ④播头丸在一定条件下能否与浓HN03发生硝化反应? . ⑤写出 “摇头丸 在加热加压和有催化剂时跟H2反应的方程式: . ⑥“摇头丸 能否跟浓盐酸反应?若能.写出生成物的结构简式,若不能.请说明理由 . 解析:1.①计算选项物质中氮的质量分数.即可确定答案.通过计算.只有B物质中氮的质量分数为:14÷135×100%=10.37%.故本题答案选B项. ②据苯分子结构推知本题答案应选B项. ③“摇头丸 分子间的作用力属于范德华力.分子间以分子间作用力互相结合的晶体叫分子晶体.故本题应选A项. ④因分子中含苯环.故能发生硝化反应 ⑤“摇头丸 在加热加压和有催化剂时跟H2反应的方程式: ⑥因“摇头丸 分子中的氮原子上有一对孤对电子能与H+形成配位键.故能跟盐酸反应.生成物结构为: 吗啡 “吗啡 存在于鸦片中.含量含为10%.为无色棱柱状晶体.熔点254-256℃.味若.在多数溶 剂中均难溶解.在碱性水溶液中较易溶解.它可与多种酸和多种有机酸生成易溶于水的盐. 海洛因 “海洛因 英文名Heroin.意为“英雄的 .是德国人德里赛最先从吗啡中提炼出来的.在近代中国翻译为海洛因.亦称“盐酸二乙酰吗啡 .属于合成类麻醉品.是极毒的药品.毒品市场上的海洛因多数为白色结晶粉末.极纯的海洛因俗称"白粉". 例题3:吗啡和海洛因都是严格查禁的毒品.吗啡分子中C.N.H的质量分数依次为: 71.58%.4.91%.6.67%.其余是氧. (1)通过计算得出吗啡的相对分子质量 ,吗啡的分子式是 . (2)已知海洛因是吗啡的二乙酸醋.别海洛因的相对分予质量是 ,分子式是 . 解析:(1)根据已知数据.可计算氧的质量分数为:l-71.58%-4.9l%-6.67%= 16.84%.则吗啡中C.H.N.O原于数最简整数比为C:H:N:O=17:19:1:3.则最简式为:C17H19NO3式量为12×17+1×19+14×1+16×3=285.因吗啡的相对分子质量不超过300.故吗啡的相对分子质量为最简式式量即 285.其分子式就是最简式C17H19N03 (2)因为海洛因是吗啡的二乙酸酯.据酯化反应的过程: CH3COOH+R-OH→C H3COOR+H2O 则每1分子CH3COOH参加酯化反应所生成的酯比原来的醇的相对分子质量增加 60-18=42.由于海洛因是吗啡的二乙酸酯.则海洛因的相对分子质量比吗啡增加42×2=84.所以海洛因的相对分子质量为285+84=369.海洛因的分子组成比吗啡增加2 (C2H4O2-H2O)=C4H402.故海洛因的分子式为:C17H19NO3+C4H4O2=C21H23NO3. 大麻 是从大麻叶中提取的一种酚类衍生物.又叫大麻酚.大麻叶中含有多种大麻酚类衍生物.较重要的有:大麻酚.大麻二酚.四氢大麻酚.大麻酚酸.大麻二酚酸.四氢大麻酚酸.其中一种大麻酚类衍生物的结构简式如图: 例题4:大麻是一种毒品.我国政府严禁生产.销售和吸食.大麻中的主要成分为大麻酚.已知其分子式为 C21H26O2.大麻酚在空气中焚烧.可生成CO2和H2O.这个反应的化学方程式是 . 解答:2C21H26O2 +53O2 燃烧 42CO2+26H2O 咖啡因 又称咖啡碱.系质轻.柔韧.有光泽的针状结晶.无臭.味苦.具有兴奋中枢神经系统.心脏和骨胳肌及舒张血管.松驰平滑肌和利尿等作用.安全. 例题5:咖啡因对中枢神经有兴奋作用.其结构式如下.常温下.咖啡因在水中的溶解度为2 g/100g H2O.加适量水杨酸钠[C6H4].由于形成氢键而增大咖啡因的溶解度.请在附图上添加水杨酸钠与咖啡因形成的氢键. 解答: (不要求氢键的键角和方向. 但要求画在有孤对电子的氮原子上) 罂粟(Papaver somniferum L.) 罂粟碱为无色针状或棱状结晶.熔点147-148℃.易溶于苯.丙酮.热乙醇.冰醋酸.稍溶于乙醚.氯仿.不溶于水.溶于浓硫酸,加热到110℃变为玖瑰红色.至200℃则变为紫色.可与多种无机酸和有机酸结合生成结晶盐. 例题6: "虎门销烟"是禁烟运动的伟大胜利.1839年6月.收缴到的110万千克鸦片被集中运到虎门海滩.和数以万担生石灰十起投入挖好的销烟池中.-随着大网拉起.海水灌进池中.顿时地中热浪翻滚.通过各种化学和物理作用,鸦片被全部销毁.鸦片是黑色青状物.它含有二十多种成分.吗啡和罂粟碱是其中有效成分中较主要的两种 在吗啡和罂粟碱的分子中.都含有相同的基团是(“-CH3 .“-CH2- 等键烃基除外) .所以它们都可以看作是芳香族化合物,其中.能与 NaOH溶液发生中和的是 .lmol这种物质能被 mol NaOH中和. 较强的碱性和较高的温度是鸦片在池中被销毁的原因之一.海水灌进池后,产生较强碱性的原因是 .由于这是一个 反应.所以产生较高的温度. 答案:苯环.吗啡.2.CaO+H20=Ca(OH)2.放热. 例题7:鸦片具有复杂的组成.其中的罂粟碱的分子结构如下: 鸦片最早用于药物.长期服用会成瘾.使人体质衰弱.精神颓废.寿命缩短.已知该物质的燃烧产物为CO2.H2O和N2.1 mol该化合物完全燃烧消耗O2的物质的量及在一定条件下与Br2发生苯环取代反应生成的一溴代物同分异构体的种数分别是 24.5 mol,7 26.5 mol,6 解答:罂粟碱分子式为C20H21O4N .燃烧方程式: C20H21O4N +23.25 O2 20CO2+10.5H2O+0.5N2 结构中含两个苯环.苯环上共5个位置可取代.选(A) 课堂练习1.[点题]新兴的大脑营养学研究发现.大脑的生长发育与不饱和脂肪酸有密切关系.被称为脑黄金的DHA就是一种不饱和程度很高的脂肪酸.它的分子中有6个C=C键.学名二十六碳六烯酸.它的分子组成是 A.C25H50COOH B.C25H39COOH C.C26H41COOH D.C26H47COOH [点晴] B
网址:http://m.1010jiajiao.com/timu3_id_377772[举报]
 (2010?宝鸡三模)[化学-选修3物质结构与性质]
(2010?宝鸡三模)[化学-选修3物质结构与性质]现有A、B、C、D、E、F、G七种原子序数小于36的元素,其原子序数的依次增大,其中A、B、C、D、E为短周期元素.
已知:①A、C两元素的基态原子中P能级上均有2个未成对电子;
②D是短周期中电负性最小的元素;
③E是一种非金属元素,其基态原子中P能级上有1个未成对电子;
④元素F与元素D同族;
⑤元素G的基态原子中d能级上有3个空轨道.
请回答下列问题:
(1)元素B与元素C的第一电离能大小比较为
N
N
>O
O
(填元素符号),元素B与元素C对应氢化物的稳定性大小比较为H2O
H2O
>NH3
NH3
(填分子式).(2)元素A与元素E形成的分子中各原子最外层均达到了8电子结构,该分子里的中心 原子的杂化轨道类型为
sp3
sp3
,分子中相邻化学键之间的夹角为109°28′
109°28′
.(3)元素D与元素F分别与元素E形成的晶体熔点高低的比较为
NaCl
NaCl
>KCl
KCl
(填化学式),原因为NaCl晶体的晶格能大于KCl晶体的晶格能
NaCl晶体的晶格能大于KCl晶体的晶格能
.(4)元素G的基态原子的核外电子排布式为
1s22s22p63s23p63d24s2
1s22s22p63s23p63d24s2
.(5)由元素G与元素C组成的一种矿石叫金红石,其晶体的一个晶胞结构如右图所示,则可推知金红石的化学式为
TiO2
TiO2
.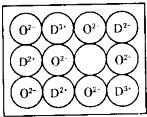 【化学-选修物质结构与性质】
【化学-选修物质结构与性质】已知A、B、C、D均为周期表中前36号元素,且原子序数依次增大.A、B、C为同一周期的主族元素,A原子最外层有3个未成对电子,B原子p能级电子总数与s能级电子总数相等.D是周期表1-18列中的第10列元素.请回答:
(l)C的电子排布图为
(2)A、B两元素的第一电离能较大的是
(3)A的氢化物的VSEPR模型立体结构为
(4)D属于元素周期表中第
(5)元素D的氧化物DO晶体结构与NaCl晶体结构相同,已知D2+与最近O2-的核间距离为acm,DO的摩尔质量为Mg/mol,若用“NAA表示阿伏加德罗常数,则DO晶体的密度为
(6)天然的和绝大部分人工制备的晶体都存在各种缺陷,某种DO晶体中就存在如图所示的缺陷:一个D2+空缺,另有两个D2+被两个D3+所取代.其结果晶体仍呈电中性,但化合物中D和O的比值却发生了变化.其氧化D样品组成为D0.97O,则该晶体中D3+与D2+的离子个数比为
碳与硅是十分重要的两种元素,金刚石、SiC具有耐磨、耐腐蚀特性,应用广泛.
(1)碳元素在周期表中的位置是 ,其原子核外通常未成对电子数为 个.
(2)已知2Ca3(PO4)2(s)+10C(s)→P4(g)+6CaO(s)+10CO(g)反应中,被破坏的化学键有 .
a.离子键 b.极性共价键 c.非极性共价键
(3)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,除去粗产品中少量钠的试剂为 .
(4)下列叙述正确的有 (填序号),
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④Si在一定条件下可与FeO发生置换反应.
查看习题详情和答案>>
(1)碳元素在周期表中的位置是
(2)已知2Ca3(PO4)2(s)+10C(s)→P4(g)+6CaO(s)+10CO(g)反应中,被破坏的化学键有
a.离子键 b.极性共价键 c.非极性共价键
(3)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,除去粗产品中少量钠的试剂为
(4)下列叙述正确的有
①Na还原CCl4的反应、Cl2与H2O的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③Na2SiO3溶液与SO3的反应可用于推断Si与S的非金属性强弱
④Si在一定条件下可与FeO发生置换反应.
A、B、C、D、E五种元素,其元素性质或原子结构相关信息如下表.
(1)A元素基态原子核外有
(2)B元素基态原子的价电子轨道表示式为
 .
.
(3)C元素最简单氢化物中,中心原子的
(4)C、D和E三种元素第一电离能由大到小的顺序为
(5)比较D和E最高价氧化物对应水化物的碱性强弱:D
(6)A元素和氯元素可形成极性分子ACl3(A元素的电负性大于氯),推测ACl3和水反应的主要产物是
查看习题详情和答案>>
| 元素编号 | 元素性质或原子结构 |
| A | 基态原子第2电子层上p轨道半充满 |
| B | 基态原子有8种不同的运动状态 |
| C | 元素对应的单质可制成半导体材料 |
| D | 第3周期第13列元素 |
| E | 基态原子共有4个能级,没有未成对电子 |
5
5
个原子轨道填充了电子.(2)B元素基态原子的价电子轨道表示式为


(3)C元素最简单氢化物中,中心原子的
sp3
sp3
轨道与氢原子的1s轨道重叠成键.(4)C、D和E三种元素第一电离能由大到小的顺序为
Si>Mg>Al
Si>Mg>Al
(填元素符号).(5)比较D和E最高价氧化物对应水化物的碱性强弱:D
<
<
E(填“>”或“<”).(6)A元素和氯元素可形成极性分子ACl3(A元素的电负性大于氯),推测ACl3和水反应的主要产物是
HClO、NH3?H2O
HClO、NH3?H2O
(填化学式). 【化学--选修3:物质结构与性质】
【化学--选修3:物质结构与性质】已知X、Y和Z三种元素的原子序数之和等于48.X的一种1:2型氢化物分子中既有σ键又有π键,所有原子共平面.Z是金属元素,Z的单质和化合物有广泛的用途.已知Z的核电荷数小于28,且次外层有2个未成对电子.工业上利用ZO2和碳酸钡在熔融状态下制化合物M(M可看做一种含氧酸盐).经X射线分析,M晶体的最小重复单元为正方体(如图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占.
(1)Y2+的结构示意图


3d24s2
3d24s2
.(2)X在该氢化物中以
sp2
sp2
方式杂化;X和Y形成的化合物YX2的电子式为

(3)①制备M的化学反应方程式是
TiO2+BaCO3
BaTiO3+CO2↑
| ||
TiO2+BaCO3
BaTiO3+CO2↑
;
| ||
②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的
面心
面心
;③已知O2-半径为1.4×10-10 m,Z4+的半径为6.15×10-11m,阿佛加德罗常数为NA,则M的密度为
| 233g/mol |
| (4.03×10-8 cm)3NA |
| 233g/mol |
| (4.03×10-8 cm)3NA |