网址:http://m.1010jiajiao.com/timu3_id_377550[举报]
(1)1.00 mol FeS2被完全氧化,需要空气的体积(标准状况)为________L。
(2)
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.080 0,计算SO2的含量。
(4)设氧化FeS2产生的气体混合物为

说明:为方便作图,纵坐标用13 b表示。
查看习题详情和答案>>硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:①二氧化硫的制取和净化;②二氧化硫转化为三氧化硫;③三氧化硫的吸收和硫酸的生成。
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为L。
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气中的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
| 实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
| 1 | 3.62 | 50.00 | 0.896 |
| 2 | 7.24 | 50.00 | 1.792 |
| 3 | 10.86 | 50.00 | 2.016 |
| 4 | 14.48 | 50.00 | 1.568 |
(1)由1组数据直接推测:用1.81 g样品进行同样实验时,生成氨气的体积(标准状况)为 L。
(2)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为 。
(3)求所用NaOH溶液的物质的量浓度。(写出计算过程)
查看习题详情和答案>>
设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为 L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为 L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为100 L,其中O2为a L,SO2为b L。
①写出a和b的关系式。
②在图中画出a和b的关系曲线(氧化FeS2时,空气过量20%)。
说明:为方便作图,纵坐标用13b表示。
查看习题详情和答案>>(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为________ L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为________ L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为100 L,其中O2为a L,SO2为b L。
①写出a和b的关系式。
②在下图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)。
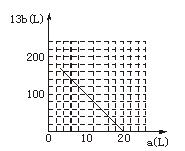
说明:为方便作图,纵坐标用13b表示。
查看习题详情和答案>>