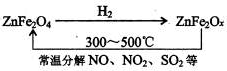
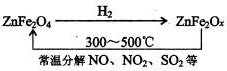
题目内容
硫铁矿高温下被空气氧化产生二氧化硫:4FeS2+11O2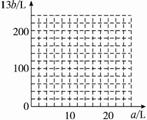
设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为 L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为 L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为100 L,其中O2为a L,SO2为b L。
①写出a和b的关系式。
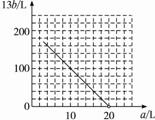
②在图中画出a和b的关系曲线(氧化FeS2时,空气过量20%)。
说明:为方便作图,纵坐标用13b表示。
解析:(1)V(空气)=1.00 mol×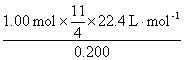 =
=
(2)V(总)=V(N2)+V(SO2)=55 L×0.800+55 L×0.200×![]() =52 L
=52 L
(3)设SO2为x(体积分数),则有4×(![]() ×11+0.0800)=1-0.0800-x
×11+0.0800)=1-0.0800-x
解得x=0.0923
(4)根据反应前后N2的体积不变,有4×(![]() b+a)=100-a-b
b+a)=100-a-b
化简得:13b=200-10a
答案:(1)308(2)52(3)0.0923(4)①13b=200
②作图如下:

练习册系列答案
相关题目