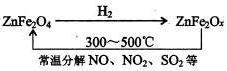
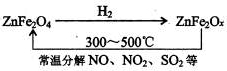
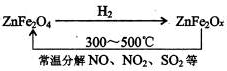
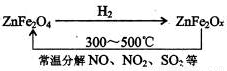
题目内容
硫铁矿高温下被空气氧化产生二氧化硫:4FeS2+11O2=8SO2+2Fe2O3。设空气中N2、O2的含量分别为?0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:(1)1.00 mol FeS2被完全氧化,需要空气的体积(标准状况)为________L。
(2)
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.080 0,计算SO2的含量。
(4)设氧化FeS2产生的气体混合物为
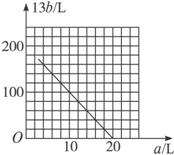
说明:为方便作图,纵坐标用13 b表示。
解析:(1)根据反应的化学方程式可知,1.00 mol FeS2被完全氧化需要氧气11/4 mol,转化为空气的体积(标准状况)为11/4 mol×
(2)采用差量法求,设反应减少的体积为x。
4FeS2+11O2=8SO2+2Fe2O3 ΔV
11 3
解得x=
(3)设SO2为y(体积分数),则有4×(y/8×11+0.080 0)=1-0.080 0-y,解得y=0.092 3。
(4)①
②根据上述关系式可作图。
答案:(1)308 (2)52 (3)0.092 3 (4)①13b=200


练习册系列答案
相关题目