摘要: 将氯化氢气体通入苯中制得HCl的苯溶液.对此溶液的描述正确的是( ) A.该溶液能导电 B.与大理石作用产生CO2气体 C.该溶液中有少量氯苯分子 D.向该溶液中通入氨气产生白色沉淀
网址:http://m.1010jiajiao.com/timu3_id_377442[举报]
化学是一门以实验为基础的科学。
(1)下列叙述正确的是 (填写序号)。
①将0.2mol·L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体。
②将95g的蒸馏水,倒人盛有5g氯化钠的烧杯中,搅拌溶解,配制5%的食盐水。
③用苯萃取溴水中的Br2,分液时,苯层从分液漏斗的下口放出。
④使用容量瓶、滴定管、分液漏斗时,首先应检验是否漏水。
⑤将混合气体通过盛有饱和Na2CO3溶液的洗气瓶,除去CO2中HCl。
(2)A、B、C、D四种固体均可溶于水,组成它们的阳离子为:Na+、Mg2+、Al3+、Ba2+;阴离子为:OH-、Cl-、CO32-、SO42-。分别取它们的水溶液进行实验,结果如下:
①A与B、C、D反应均可产生白色沉淀;
②B溶液与适量的D溶液反应生成白色沉淀,加入过量的D溶液时,沉淀量减少但不消失。则A为 C为 (填写化学式);
B溶液与NaHCO3溶液反应的离子方程式为 。
查看习题详情和答案>>溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.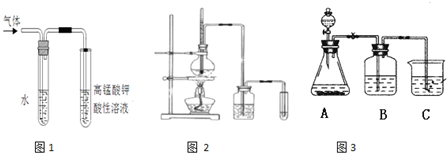
反应类型
(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式
图2是实验室制乙烯并检验其性质的装置图,请回答:
(1)写出圆底烧瓶中反应的方程式
(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:
(3)为了检验乙烯的生成,试管中应盛放
(4)洗瓶中盛放的试剂为
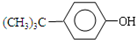
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图3所示的装置图进行实验:
(1)锥形瓶内装某可溶性盐,写出A中反应的离子方程式:
(2)C中的现象为
(3)B中的试剂为
查看习题详情和答案>>

反应类型
取代
取代
.某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3 溶液,加热,产生少量沉淀.该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因:不合理没有用硝酸中和氢氧化钠溶液
不合理没有用硝酸中和氢氧化钠溶液
.(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式
CH2BrCH3+NaOH
CH2=CH2↑+H2O+NaBr
| 醇 |
| 加热 |
CH2BrCH3+NaOH
CH2=CH2↑+H2O+NaBr
反应类型| 醇 |
| 加热 |
消去反应
消去反应
.反应中生成的气体可以用图1所示装置检验,现象是溶液褪色
溶液褪色
,水的作用是吸收乙醇
吸收乙醇
.除高锰酸钾酸性溶液外,还可以用溴的四氯化碳溶液
溴的四氯化碳溶液
检验生成的气体,此时还有必要将气体先通入水中吗?没有
没有
(填“有”或“没有”)图2是实验室制乙烯并检验其性质的装置图,请回答:
(1)写出圆底烧瓶中反应的方程式
CH3CH2OH
CH2=CH2↑+H2O
| 浓H2SO4 |
| 170℃ |
CH3CH2OH
CH2=CH2↑+H2O
,反应类型| 浓H2SO4 |
| 170℃ |
消去反应
消去反应
;(2)烧瓶中混合液逐渐变黑,并产生某些无机杂质气体,写出产生杂质气体的化学方程式:
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
| ||
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
;
| ||
(3)为了检验乙烯的生成,试管中应盛放
高锰酸钾溶液(或溴的四氯化碳溶液)
高锰酸钾溶液(或溴的四氯化碳溶液)
,现象为溶液褪色
溶液褪色
;(4)洗瓶中盛放的试剂为
氢氧化钠溶液
氢氧化钠溶液
,作用吸收SO2CO2
吸收SO2CO2
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图3所示的装置图进行实验:
(1)锥形瓶内装某可溶性盐,写出A中反应的离子方程式:
CO32-+2H+=H2O+CO2↑
CO32-+2H+=H2O+CO2↑
;(2)C中的现象为
白色浑浊
白色浑浊
,写出C中反应的化学方程式:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,
(3)B中的试剂为
饱和碳酸氢钠溶液
饱和碳酸氢钠溶液
,作用吸收CO2中的HCl
吸收CO2中的HCl
.(2010?清远模拟)Fridel-Crafts反应是向苯环上引入烷基最重要的方法,在合成上有很大的实用价值,该反应可以简单表示如下:ArH+RX
ArR+HX;△H<0(Ar表示苯基).某化学兴趣小组在实验室先利用叔丁醇与盐酸反应制得叔丁基氯(沸点50.7℃),再利用Fridel-Crafts反应原理制备对叔丁基苯酚(熔点99℃).反应流程及实验装置如下图所示:
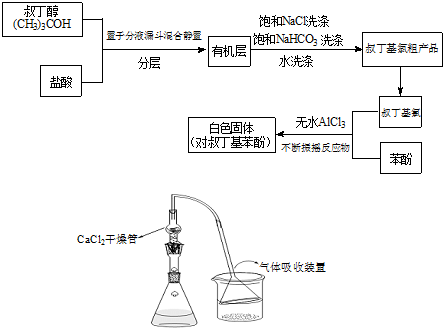
试回答下列问题:
(1)请写出本实验过程中的两个主要化学反应方程式: +(CH3)3CCl
+(CH3)3CCl
 +HCl
+HCl +(CH3)3CCl
+(CH3)3CCl
 +HCl.
+HCl.
(2)有机层中加入饱和食盐水及饱和碳酸氢钠的作用可能是:
(3)若去掉该制备装置中的氯化钙干燥管,有可能导致的不良后果是(用化学方程式并配合文字说明):
(4)叔丁基氯与苯酚反应时适当控制温度是很重要的.若反应过程中温度过高应用冷水浴冷却,否则可能导致的不良后果是:
(5)常温下叔丁基氯易于发生消去反应故实验中所用的必须现用现配,试写出叔丁基氯发生消去反应的化学方程式:
(6)有时候最终产品对叔丁基苯酚不是白色而呈现紫色,你认为可能的原因是:
查看习题详情和答案>>
| 无水AlCl3 |

试回答下列问题:
(1)请写出本实验过程中的两个主要化学反应方程式:
(CH3)3COH+HCl→(CH3)3CCl+H2O
(CH3)3COH+HCl→(CH3)3CCl+H2O
, +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
 +HCl
+HCl +(CH3)3CCl
+(CH3)3CCl| 无水AlCl3 |
 +HCl
+HCl(2)有机层中加入饱和食盐水及饱和碳酸氢钠的作用可能是:
除去叔丁基氯粗产物中的HCl
除去叔丁基氯粗产物中的HCl
.通过蒸馏
蒸馏
操作可将叔丁基氯粗产物转化为较为纯净的叔丁基氯.(3)若去掉该制备装置中的氯化钙干燥管,有可能导致的不良后果是(用化学方程式并配合文字说明):
AlCl3+3H2O=Al(OH)3+3HCl↑,催化剂三氯化铝水解变质
AlCl3+3H2O=Al(OH)3+3HCl↑,催化剂三氯化铝水解变质
.(4)叔丁基氯与苯酚反应时适当控制温度是很重要的.若反应过程中温度过高应用冷水浴冷却,否则可能导致的不良后果是:
反应放热使温度升高,且生成大量的HCl气体,若不及时冷却,叔丁基氯的蒸气易逸出而影响产率
反应放热使温度升高,且生成大量的HCl气体,若不及时冷却,叔丁基氯的蒸气易逸出而影响产率
.(5)常温下叔丁基氯易于发生消去反应故实验中所用的必须现用现配,试写出叔丁基氯发生消去反应的化学方程式:
(CH3)3CCl→CH2=C(CH3)2+HCl↑
(CH3)3CCl→CH2=C(CH3)2+HCl↑
.(6)有时候最终产品对叔丁基苯酚不是白色而呈现紫色,你认为可能的原因是:
一部分苯酚被空气中的氧气所氧化
一部分苯酚被空气中的氧气所氧化
.化学是一门以实验为基础的科学.
(1)下列叙述正确的是______(填写序号).
①将0.2mol?L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体.
②将95g的蒸馏水,倒人盛有5g氯化钠的烧杯中,搅拌溶解,配制5%的食盐水.
③用苯萃取溴水中的Br2,分液时,苯层从分液漏斗的下口放出.
④使用容量瓶、滴定管、分液漏斗时,首先应检验是否漏水.
⑤将混合气体通过盛有饱和Na2CO3溶液的洗气瓶,除去CO2中HCl.
(2)A、B、C、D四种固体均可溶于水,组成它们的阳离子为:Na+、Mg2+、Al3+、Ba2+;阴离子为:OH-、Cl-、CO32-、SO42-.分别取它们的水溶液进行实验,结果如下:
①A与B、C、D反应均可产生白色沉淀;
②B溶液与适量的D溶液反应生成白色沉淀,加入过量的D溶液时,沉淀量减少但不消失.则A为______C为______(填写化学式);B溶液与NaHCO3溶液反应的离子方程式为______.
查看习题详情和答案>>
化学是一门以实验为基础的科学.
(1)下列叙述正确的是______(填写序号).
①将0.2mol?L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体.
②将95g的蒸馏水,倒人盛有5g氯化钠的烧杯中,搅拌溶解,配制5%的食盐水.
③用苯萃取溴水中的Br2,分液时,苯层从分液漏斗的下口放出.
④使用容量瓶、滴定管、分液漏斗时,首先应检验是否漏水.
⑤将混合气体通过盛有饱和Na2CO3溶液的洗气瓶,除去CO2中HCl.
(2)A、B、C、D四种固体均可溶于水,组成它们的阳离子为:Na+、Mg2+、Al3+、Ba2+;阴离子为:OH-、Cl-、CO32-、SO42-.分别取它们的水溶液进行实验,结果如下:
①A与B、C、D反应均可产生白色沉淀;
②B溶液与适量的D溶液反应生成白色沉淀,加入过量的D溶液时,沉淀量减少但不消失.则A为______C为______(填写化学式);B溶液与NaHCO3溶液反应的离子方程式为______.
查看习题详情和答案>>
(1)下列叙述正确的是______(填写序号).
①将0.2mol?L-1FeCl3溶液滴加到沸水中,然后继续加热并不断搅拌可制得氢氧化铁胶体.
②将95g的蒸馏水,倒人盛有5g氯化钠的烧杯中,搅拌溶解,配制5%的食盐水.
③用苯萃取溴水中的Br2,分液时,苯层从分液漏斗的下口放出.
④使用容量瓶、滴定管、分液漏斗时,首先应检验是否漏水.
⑤将混合气体通过盛有饱和Na2CO3溶液的洗气瓶,除去CO2中HCl.
(2)A、B、C、D四种固体均可溶于水,组成它们的阳离子为:Na+、Mg2+、Al3+、Ba2+;阴离子为:OH-、Cl-、CO32-、SO42-.分别取它们的水溶液进行实验,结果如下:
①A与B、C、D反应均可产生白色沉淀;
②B溶液与适量的D溶液反应生成白色沉淀,加入过量的D溶液时,沉淀量减少但不消失.则A为______C为______(填写化学式);B溶液与NaHCO3溶液反应的离子方程式为______.