摘要:中学常见的A.B.C.D.E.F六种物质在一定条件下有如下图所示的相互转化关系.所有反应物和生成物均已给出. (1)若B是水.C是一种有磁性的黑色化合物.则反应①的化学方程式为 . (2)若B为一种淡黄色固体.绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环.反应①的离子方程式是 .在反应③中.若生成1 mo1 D.则转移电子数目为 . (3)若反应①.②.③均为水溶液中的置换反应.A.D.E为卤素单质.则A.D.E的氧化性由强到弱的顺序为 .其中A的化学式是 .
网址:http://m.1010jiajiao.com/timu3_id_377367[举报]
中学常见的A、B、C、D、E、F六种物质在一定条件下有如下图所示的相互转化关系,所有反应物和生成物均已给出。
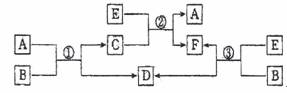
(1)若B是水,C是一种有磁性的黑色化合物,则反应①的化学方程式为 。
(2)若B为一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。反应②的化学方程式是 ,在反应③中,若生成1mol D,则转移电子数目为 。
(3)若反应①、②、③均为水溶液的置换反应,A、D、E为卤素单质,则A、D、E的氧化性由强到弱顺序为 ,其中A的化学式是 。
查看习题详情和答案>>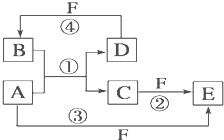 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).(1)若A为短周期金属单质,D为短周期非金属单质(一种黑色固体),且所含元素的原子序数A是D的2倍,原子的最外层电子数D是A的2倍,化合物F的浓溶液与单质A、D在一定条件下反应都有红棕色气体生成,则A在周期表中的位置为:
第三周期,ⅡA族
第三周期,ⅡA族
,B的电子式为::O::C::O:
:O::C::O:
,F的浓溶液与D在加热条件下反应的化学方程式为:C+4HNO3
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3
CO2↑+4NO2↑+2H2O
.
| ||
(2)若A是常见变价金属的单质,D、F是气态单质,且反应①②均在水溶液中进行.则反应②的离子方程式是
2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
.(3)若A、D、F都是短周期非金属元素单质,且 A、D所含元素同主族,A、F所含元素同周期,B是制作光导纤维的基本原料,则B是
SiO2
SiO2
,C是CO
CO
,F是O2
O2
.(填化学式)A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D C=E A+B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式
 ;乙为由B元素组成的单质,写出该单质的一种用途
;乙为由B元素组成的单质,写出该单质的一种用途
(2)写出某黑色含F的磁性氧化物在E的最高价氧化物对应水化物的稀溶液中反应的离子方程式:
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目:
 .
.
(5)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2.则该复盐的化学式为
查看习题详情和答案>>
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D C=E A+B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式


作保护气
作保护气
.(2)写出某黑色含F的磁性氧化物在E的最高价氧化物对应水化物的稀溶液中反应的离子方程式:
Fe3O4+8H+═2Fe3++Fe2++4H2O
Fe3O4+8H+═2Fe3++Fe2++4H2O
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为
NH4NO2+AgNO3═AgNO2↓+NH4NO3
NH4NO2+AgNO3═AgNO2↓+NH4NO3
,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为C(NO2->C(NH4+)>C(H+)>C(OH-)
C(NO2->C(NH4+)>C(H+)>C(OH-)
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目:


(5)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2.则该复盐的化学式为
(NH4)2Fe(SO4)2
(NH4)2Fe(SO4)2
.为探究该复盐中的某种离子,取少量该复盐于试管中并加水溶解,滴加铁氰化钾溶液(K3[Fe(CN)6]),则现象和结论为出现蓝色沉淀,证明有Fe2+
出现蓝色沉淀,证明有Fe2+
.A、B、C、D、E、F、G全为短周期元素,它们在中学常见化合物中显示的部分化合价及原子、离子半径从大到小的序号如下:(注:半径按①、②、③…的顺序依次减小)
(1)用电子式表示BA2的形成过程
 .
.
(2)写出F的最高价氧化物对应的水化物和G的最高价氧化物对应的水化物反应的离子方程式
(3)请设计实验比较B、F的活动性强弱.
查看习题详情和答案>>
| 元素 性质 |
A | B | C | D | E | F | G |
| 化合价 | +1、+5、+7 | 只有+2 | +4 | -3、+2、+4、+5 | 只有-1 | 只有+3 | 只有+1 |
| 原子半径 | ⑤ | ② | ④ | ⑥ | ⑦ | ③ | ① |
| 离子半径 | ① | ⑤ | 无离子 | ② | ③ | ⑥ | ④ |


(2)写出F的最高价氧化物对应的水化物和G的最高价氧化物对应的水化物反应的离子方程式
Al(OH)3+OH-═AlO2-+2H2O.
Al(OH)3+OH-═AlO2-+2H2O.
.(3)请设计实验比较B、F的活动性强弱.
| 元素 | 实验设计 | 现象 | 结论 |
| B | 活动性:B F (填“>”、“<”或“=”) | ||
| F |
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件及部分产物未列出)(1)若A是常见金属单质,与B的水溶液反应生成C和D.D、F是气体单质,D在F中燃烧时发出苍白色火焰.则F所对应的元素在周期表位置是
第三周期、第ⅦA族
第三周期、第ⅦA族
,反应②(在水溶液中进行)的离子方程式为2Fe2++Cl2=2Fe3++2Cl-
2Fe2++Cl2=2Fe3++2Cl-
;(2)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,且③④两个反应都有红棕色气体生成,则反应①、④的化学方程式分别为
①
2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
,
| ||
④
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
;
| ||
(3)若A、D、F都是短周期非金属单质,且A、D所含元素同主族,A、F所含元素同周期,C是一种能与血红蛋白结合的有毒气体;则物质B的晶体类型是
原子晶体
原子晶体
,分子E的结构式是O=C=O
O=C=O
.