摘要: 下图为短周期的一部分.推断关于Y.Z.M的说法正确的是( ) X Y Z M A. 非金属性:Y>Z>M B. 原子半径:M>Z>Y C. 气态氢化物的稳定性:Y<M<Z D. 分子中各原子的最外层电子均满足稳定结构 11.+nB.△H<0.在一定温度下. 平衡时B的体积分数(B%)与压强变化的关系如图所示.下列 叙述中一定正确的是 ( ) ①m+n>p ②x点表示的正反应速度大于逆反应速率 20070326 ③n>p ④x点比y点时的反应速率慢 ⑤若升高温度.该反应的平衡常数增大 A.①②⑤ B.只有②④ C.只有①③ D.只有①③⑤
网址:http://m.1010jiajiao.com/timu3_id_377180[举报]
A~H均为有机化合物,它们之间的转化如下图所示:

提示:已知反应
实验表明:①D既能发生银镜反应,又能与金属钠反应放出氢气;②F不能使溴水褪色;③G能使溴的四氯化碳溶液褪色.
请根据以上信息回答下列问题:
(1)A的结构简式为
(2)D的结构简式为
(3)由E生成F的化学方程式为
 ,与E具有相同官能团的E的同分异构体还有
,与E具有相同官能团的E的同分异构体还有
 (写出结构简式,只要写2个);
(写出结构简式,只要写2个);
(4)G的结构简式为
 ;
;
(5)由G生成H的化学方程式为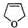 +CH2=CHCH=CH2
+CH2=CHCH=CH2

 +CH2=CHCH=CH2
+CH2=CHCH=CH2
 .
.
查看习题详情和答案>>

提示:已知反应

实验表明:①D既能发生银镜反应,又能与金属钠反应放出氢气;②F不能使溴水褪色;③G能使溴的四氯化碳溶液褪色.
请根据以上信息回答下列问题:
(1)A的结构简式为
BrCH2CH=CHCH2Br
BrCH2CH=CHCH2Br
,由A生成B的反应类型是取代反应或水解
取代反应或水解
反应;(2)D的结构简式为
HOCH2CH2CH2CHO
HOCH2CH2CH2CHO
.(3)由E生成F的化学方程式为




(4)G的结构简式为


(5)由G生成H的化学方程式为
 +CH2=CHCH=CH2
+CH2=CHCH=CH2| △ |

 +CH2=CHCH=CH2
+CH2=CHCH=CH2| △ |

 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液,下图是医院给病人输液时使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液的标签.某学生欲在实验室中配制500mL该葡萄糖注射液.实验用品:葡萄糖固体、蒸馏水、烧杯、容量瓶(500mL)、药匙、胶头滴管、量筒.
(1)还缺少的仪器有
托盘天平、玻璃棒
托盘天平、玻璃棒
.(2)下列对容量瓶及使用的描述中不正确的是
ACD
ACD
.A.容量瓶上标有容积、温度和浓度
B.使用前要检查容量瓶是否漏水
C.容量瓶用蒸馏水洗净后,再用5%葡萄糖注射液洗
D.配制溶液时,把称好的葡萄糖晶体小心倒入容量瓶中,加入蒸馏水到接近刻度线1~2cm处,改用胶头滴管加蒸馏水至刻度线
(3)实验中需取用固体的质量为
27.0
27.0
g,该葡萄糖注射液的物质的量浓度0.3
0.3
mol/L.(4)配制该葡萄糖注射液,下列操作会导致所配溶液的物质的量浓度偏高的是
B
B
.A.没有将洗涤液转移到容量瓶 B.定容时俯视刻度线
C.容量瓶洗净后未干燥 D.定容时液面超过了刻度线.
(2011?锦州模拟)海水资源丰富,海水中主要含有Na+、K+、Mg2+、Cl-、SO2-4、Br-、CO2-3、HCO-3等离子.合理利用海水资源和保护环境是我国可持续发展的重要保证.
Ⅰ.火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如下图所示:
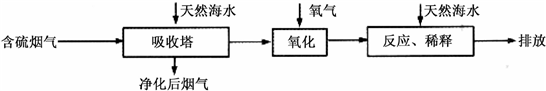
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g?mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
(3)你认为往废水中投入
A.NaOH B.Na2S C.KID.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
(5)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%.若环境要求排放标准为c(Ag+)低于1.0×10-8mol?L-1,问该工厂处理后的废水中c(Ag+)=
已知KSP(AgCl)=1.8×1-10mol?L2.
查看习题详情和答案>>
Ⅰ.火力发电燃烧煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如下图所示:

(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因
CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-
CO32-+H2O?HCO3-+OH-或HCO3-+H2O?H2CO3+OH-
.(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是
2H2SO3+O2═2H2SO4
2H2SO3+O2═2H2SO4
;氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸
中和、稀释经氧气氧化后海水中生成的酸
.Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.0,ρ≈1g?mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.1mol?L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | pbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
B
B
(填字母序号),沉淀效果最好.A.NaOH B.Na2S C.KID.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=
1.2×10-3mol?L-1
1.2×10-3mol?L-1
.(5)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%.若环境要求排放标准为c(Ag+)低于1.0×10-8mol?L-1,问该工厂处理后的废水中c(Ag+)=
9×10-9mol?L-1
9×10-9mol?L-1
,是否符合排放标准是
是
(填“是”或“否”).已知KSP(AgCl)=1.8×1-10mol?L2.
