摘要:7.肼(N2H4)是一种常用的火箭燃料.对应的氧化剂通常用过氧化氢.如果火箭推进器中盛有液态的肼和液态过氧化氢.当它们混合反应时立即产生大量的氮气和水蒸气.同时放出大量的热.已知0.4 mol液态肼与足量液态过氧化氢发生反应.可放出256.6 kJ的热量.下列热化学方程式正确的是 A.N2H4(l) + 2H2O2(l) = N2(g) + 4H2O(l) △H=-256.6kJ/mol B.N2H4(l) + 2H2O2(l) = N2(g) + 4H2O(g) △H=-641.5kJ/mol C.N2H4(l) + 2H2O2(g) = N2(g) + 4H2O(g) △H=-641.5kJ/mol B.N2H4(l) + 2H2O2(l) = N2(g) + 4H2O(g) △H= + 641.5kJ/mol
网址:http://m.1010jiajiao.com/timu3_id_376615[举报]
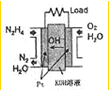 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.度回答下列问题
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.度回答下列问题(1)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,尿素和次氯酸钠-氢氧化钠溶液反应获得,尿素法反应的化学方程式为:
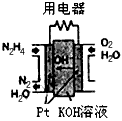
(2)直接肼燃料电池原理如右图所示,通入N2H4的极为电池的
(3)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
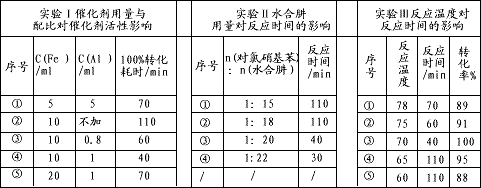
(4)肼的水合物(水合肼,N2H4?2H2O)是一种强还原剂,某文献报道用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,某次实验部分记录如下:
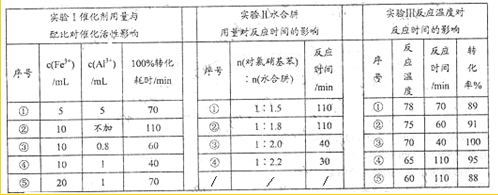
请分别从实验Ⅰ、Ⅱ、Ⅲ组合出最佳条件依次为
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料。回答下列问题

(1)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,尿素和次氯酸钠-氢氧化钠溶液反应获得,尿素法反应的化学方程式为:__________________________。
(2)直接肼燃料电池原理如上图所示,通入N2H4的极为电池的___________极。
(3)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H=-67.7kJ·mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ·mol-1
2NO2(g)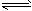 N2O4(g) △H=-52.7kJ·mol-1 试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:__________________________。
N2O4(g) △H=-52.7kJ·mol-1 试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:__________________________。
(4)肼的水合物(水合肼,N2H4·2H2O)是一种强还原剂,某文献报道用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,某次实验部分记录如下
(2)直接肼燃料电池原理如上图所示,通入N2H4的极为电池的___________极。
(3)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H=-67.7kJ·mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ·mol-1
2NO2(g)
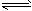 N2O4(g) △H=-52.7kJ·mol-1 试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:__________________________。
N2O4(g) △H=-52.7kJ·mol-1 试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:__________________________。 (4)肼的水合物(水合肼,N2H4·2H2O)是一种强还原剂,某文献报道用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,某次实验部分记录如下
请分别从实验Ⅰ、Ⅱ、Ⅲ组合出最佳条件依次为__________________(选用序号①②③④⑤)。
查看习题详情和答案>>
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料。请回答下列问题
(1)直接肼燃料电池原理如图所示,通入N2H4的极为电池的__________极。(填:正、负)
(1)直接肼燃料电池原理如图所示,通入N2H4的极为电池的__________极。(填:正、负)
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H=-67.7kJ·mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ·mol-1
2NO2(g) N2O4(g) △H=-52.7kJ·mol-1
N2O4(g) △H=-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:_____________________。
(3)肼的水合物(水合肼,N2H4·2H2O)是一种强还原剂,某文献报道用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,某次实验部分记录如下
N2(g)+2O2(g)=2NO2(g) △H=-67.7kJ·mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534.0kJ·mol-1
2NO2(g)
 N2O4(g) △H=-52.7kJ·mol-1
N2O4(g) △H=-52.7kJ·mol-1 试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:_____________________。
(3)肼的水合物(水合肼,N2H4·2H2O)是一种强还原剂,某文献报道用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,某次实验部分记录如下
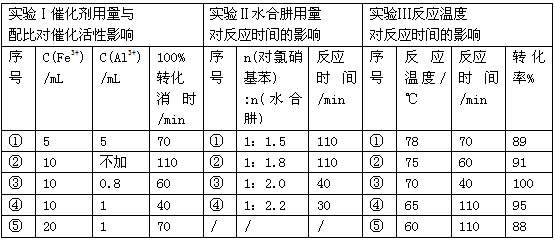
请分别从实验Ⅰ、Ⅱ、Ⅲ组合出最佳条件依次为_________________(选用序号①②③④⑤)。
(4)已知:2NO2(g)==N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应
2NO2(g)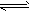 N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)
N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(5)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、
c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g)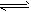 N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。
_______________________________
查看习题详情和答案>>
(4)已知:2NO2(g)==N2O4(g) △H=-57.20kJ·mol-1。一定温度下,在密闭容器中反应
2NO2(g)
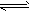 N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)
N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(5)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol·L-1、
c(N2O4)=0.0120 mol·L-1。计算反应2NO2(g)
 N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。 _______________________________
2005年10月12日“神舟”六号成功发射,并遨游太空后在内蒙古安全着陆。在航天工业中,火箭推进剂由燃料和氧化剂组成,这类反应不仅要求放出能量高,而且产物必须无污染。将“神六”送上太空的“长征2F”火箭使用的燃料主要是偏二甲肼,已知该化合物的相对分子质量为60,含碳量为40%,含氢量为13.33%,其余是氮。
(1)偏二甲肼的分子中有一个氮原子是以—N—形式存在,该氮原子不与氢原子直接相连,则偏二甲肼的结构简式为____________________;偏二甲肼的同分异构体有多种,请任意写出其中两种的结构简式________________________________________。
(2)对偏二甲肼结构和性质的推测正确的有____________。
A.偏二甲肼属于无机化合物
B.固态时是分子晶体
C.偏二甲肼分子中含有离子键
D.分子中的所有N原子和C原子都在同一平面上
(3)偏二甲肼作为火箭燃料燃烧时,以N2O4为氧化剂,燃烧产物只有N2、CO2和H2O。这一反应的化学方程式为____________________________________________________。
(4)肼(N2H4)也是一种常用的火箭燃料,对应的氧化剂,通常用过氧化氢。1 g液态的肼与足量的过氧化氢反应时放出25.6 kJ的热量(通常状况测定)。肼和过氧化氢反应的热化学方程式是____________________________________________________________。
查看习题详情和答案>>