题目内容
 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.度回答下列问题
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.度回答下列问题(1)联氨的工业生产常用氨和次氯酸钠为原料获得,也可在高锰酸钾催化下,尿素和次氯酸钠-氢氧化钠溶液反应获得,尿素法反应的化学方程式为:
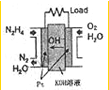
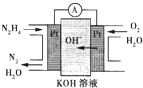
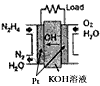
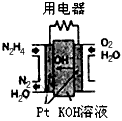
(2)直接肼燃料电池原理如右图所示,通入N2H4的极为电池的
(3)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1,
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
(4)肼的水合物(水合肼,N2H4?2H2O)是一种强还原剂,某文献报道用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,某次实验部分记录如下:
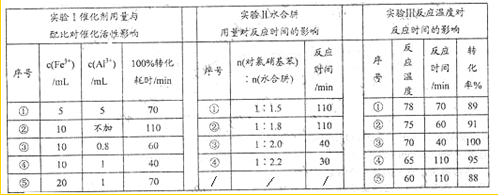
请分别从实验Ⅰ、Ⅱ、Ⅲ组合出最佳条件依次为
分析:(1)根据反应物与生成物来书写化学反应方程式;
(2)利用N元素的化合价变化及负极发生氧化反应来分析;
(3)①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1,
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1,
利用盖斯定律可知,②×2-③-①得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);
(4)用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,实验I中④的时间最少,实验Ⅱ中④的时间最少,实验Ⅲ中转化率最大.
(2)利用N元素的化合价变化及负极发生氧化反应来分析;
(3)①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1,
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1,
利用盖斯定律可知,②×2-③-①得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);
(4)用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,实验I中④的时间最少,实验Ⅱ中④的时间最少,实验Ⅲ中转化率最大.
解答:解:(1)尿素和次氯酸钠-氢氧化钠溶液反应生成肼、碳酸钠、氯化钠、水,该化学反应方程式为CO(NH2)2+NaClO+2NaOH=N2H4+Na2CO3+NaCl+2H2O,
故答案为:CO(NH2)2+NaClO+2NaOH=N2H4+Na2CO3+NaCl+2H2O;
(2)由原电池可知,肼中N元素的化合价升高,负极发生氧化反应,则肼为负极,故答案为:负极;
(3)①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1,
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1,
利用盖斯定律可知,②×2-③-①得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=△H2×2-△H1-△H3=-947.6 kJ?mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ?mol-1;
(4)用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,由实验数据可知实验I中④的时间最少,实验Ⅱ中④的时间最少,实验Ⅲ中转化率最大,则最佳条件为
④④③,故答案为:④④③.
故答案为:CO(NH2)2+NaClO+2NaOH=N2H4+Na2CO3+NaCl+2H2O;
(2)由原电池可知,肼中N元素的化合价升高,负极发生氧化反应,则肼为负极,故答案为:负极;
(3)①N2(g)+2O2(g)=2NO2(g)△H=-67.7kJ?mol-1,
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ?mol-1
③2NO2(g)?N2O4(g)△H=-52.7kJ?mol-1,
利用盖斯定律可知,②×2-③-①得2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=△H2×2-△H1-△H3=-947.6 kJ?mol-1,
故答案为:2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g)△H=-947.6 kJ?mol-1;
(4)用Fe-Al复合催化剂催化水合肼可选择性还原对氯硝基苯制备对氯苯胺,由实验数据可知实验I中④的时间最少,实验Ⅱ中④的时间最少,实验Ⅲ中转化率最大,则最佳条件为
④④③,故答案为:④④③.
点评:本题为综合题,涉及化学反应方程式的书写、盖斯定律计算反应热及热化学方程式的书写、原电池、影响反应速率及平衡的因素,注重学生知识的迁移能力的考查,题目难度中等.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
 肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题:
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用的氧化剂,请回答下列问题: (2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
(2013?河西区一模)肼(N2H4)和氨是氮的两种常见化合物,在科学技术和生产中有广泛应用.请按要求回答下列问题:
 N2O4(g) △H=-52.7kJ·mol-1 试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:__________________________。
N2O4(g) △H=-52.7kJ·mol-1 试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:__________________________。 
 N2O4(g) △H=-52.7kJ·mol-1
N2O4(g) △H=-52.7kJ·mol-1 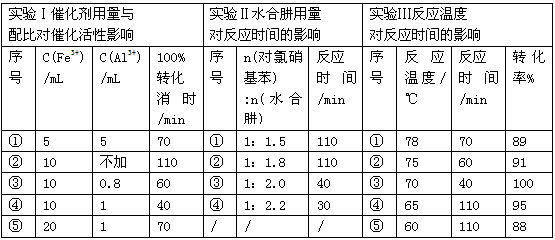
 N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母)
N2O4(g)达到平衡。其他条件不变时,下列措施能提高NO2转化率的是__________(填字母) N2O4(g)的平衡常数K。
N2O4(g)的平衡常数K。