摘要:向pH=2的某酸溶液和pH=12的氢氧化钠溶液中.加入足量的铝片.放出H2的物质的量之比为2:1其原因可能是 ( ) A.两溶液的体积相同.酸是二元强酸 B.两溶液的体积相同.酸是弱酸 C.若酸为一元弱酸.酸溶液的体积是碱溶液体积的2倍 D.酸是强酸.且酸溶液的浓度比NaOH溶液浓度大
网址:http://m.1010jiajiao.com/timu3_id_376311[举报]
蛇纹石可用于生产氢氧化镁,简要工程如下:
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol?L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁:向步骤Ⅱ所得溶液中加入过量氨水.
已知:金属离子氢氧化物沉淀所需pH如表.
请回答:
(1)步骤Ⅱ中,可用于调节溶液pH至7~8的最佳试剂是
A.MgO B.Na2CO3 C.蒸馏水
(2)检验粗硫酸镁溶液中Fe2+的方法是:
(3)步骤Ⅲ中制备氢氧化镁反应的离子方程式为
(4)步骤Ⅱ沉淀后溶液中主要存在(NH4)2SO4,已知室温下0.1mol?L-1的(NH4)2SO4溶液pH是5,则溶液中离子浓度由大到小的排列为
(5)某生产科研小组经查阅资料得到以下溶度积Ksp数据(298K时):
Mg(OH)2(S)?Mg2+(aq)+2OH-(aq) Ksp=[Mg2+]?[OH-]2=5.6×10-12
Ca(OH)2(S)?Ca2+(aq)+2OH-(aq) Ksp=[Ca2+]?[OH-]2=4.7×10-6
该科研小组认为可以用熟石灰替代氨水制得氢氧化镁,他们的理由是
若沉淀转化反应为:Mg2+(aq)+Ca(OH)2(S)?Mg(OH)2(S)+Ca2+(aq),求此温度下该反应的化学平衡常数K=
查看习题详情和答案>>
Ⅰ.制取粗硫酸镁:用酸液浸泡蛇纹石矿粉,过滤,并在常温常压下结晶,制得粗硫酸镁(其中常含有少量Fe3+、Al3+、Fe2+等杂质离子)
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol?L-1H2O2溶液,再调节溶液pH至7~8,并分离提纯.
Ⅲ.制取氢氧化镁:向步骤Ⅱ所得溶液中加入过量氨水.
| Fe3+ | Al3+ | Fe2+ | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
请回答:
(1)步骤Ⅱ中,可用于调节溶液pH至7~8的最佳试剂是
A
A
(填字母序号)A.MgO B.Na2CO3 C.蒸馏水
(2)检验粗硫酸镁溶液中Fe2+的方法是:
取少量粗硫酸镁溶液,滴加少量酸性KMnO4溶液;若紫红色褪去,说明Fe2+存在
取少量粗硫酸镁溶液,滴加少量酸性KMnO4溶液;若紫红色褪去,说明Fe2+存在
(注明试剂、现象).(3)步骤Ⅲ中制备氢氧化镁反应的离子方程式为
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
Mg2++2NH3?H2O=Mg(OH)2↓+2NH4+
.(4)步骤Ⅱ沉淀后溶液中主要存在(NH4)2SO4,已知室温下0.1mol?L-1的(NH4)2SO4溶液pH是5,则溶液中离子浓度由大到小的排列为
C(NH4+)>C(SO42-)>C(H+)>C(OH-)
C(NH4+)>C(SO42-)>C(H+)>C(OH-)
,溶液中:2c(SO42-)-c(NH4+)=10-5-10-9
10-5-10-9
mol?L-1(用精确数值表示)(5)某生产科研小组经查阅资料得到以下溶度积Ksp数据(298K时):
Mg(OH)2(S)?Mg2+(aq)+2OH-(aq) Ksp=[Mg2+]?[OH-]2=5.6×10-12
Ca(OH)2(S)?Ca2+(aq)+2OH-(aq) Ksp=[Ca2+]?[OH-]2=4.7×10-6
该科研小组认为可以用熟石灰替代氨水制得氢氧化镁,他们的理由是
Mg(OH)2的溶解度小于Ca(OH)2,可发生沉淀的转化,如:Mg(OH)2和Ca(OH)2离子个数比相同,Ksp[Mg(OH)2]<Ksp[Ca(OH)2],故沉淀向着溶度积更小的方向转化
Mg(OH)2的溶解度小于Ca(OH)2,可发生沉淀的转化,如:Mg(OH)2和Ca(OH)2离子个数比相同,Ksp[Mg(OH)2]<Ksp[Ca(OH)2],故沉淀向着溶度积更小的方向转化
.若沉淀转化反应为:Mg2+(aq)+Ca(OH)2(S)?Mg(OH)2(S)+Ca2+(aq),求此温度下该反应的化学平衡常数K=
8.4×105
8.4×105
(写出算式和结果).(14分)在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
(1)依据题意判断,t℃___________25℃(填“大于”、“小于”或“等于”),该温度下水的离子积常数Kw = ___________。
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(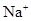 )>c(
)>c(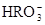 )>c(
)>c(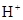 )>c(
)>c(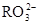 )>c(
)>c(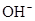 )
)
B.c(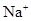 )+c(
)+c(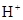 )=c(
)=c(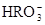 )+2c(
)+2c(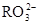 )+c(
)+c(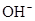 )
)
C.c(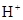 )+c(
)+c(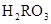 )=c(
)=c(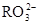 )+c(
)+c(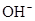 )
)
D.两溶液中c(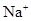 )、c(
)、c(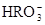 )、c(
)、c(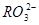 )分别相等
)分别相等
| 序号 | 氢氧化钡的体积/mL | 硫酸氢钠的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)b=____________,x =" ______mL" 。
(3)反应③的离子方程式为____________________________
(4)将此温度下的Ba(OH)2溶液取出1mL,加水稀释至1L,则稀释后溶液中
c(Ba2+)﹕c(OH-)= ;
(5) 与NaHSO4相同, NaHSO3和NaHCO3也为酸式盐。已知NaHSO3溶液呈酸性,NaHCO3溶液呈碱性。现有浓度均为0.1mol/L的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是___________(填正确答案的标号)。
A.c(
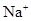 )>c(
)>c(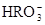 )>c(
)>c(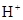 )>c(
)>c(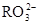 )>c(
)>c(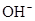 )
)B.c(
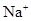 )+c(
)+c(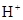 )=c(
)=c(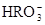 )+2c(
)+2c(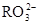 )+c(
)+c(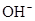 )
)C.c(
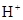 )+c(
)+c(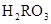 )=c(
)=c(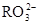 )+c(
)+c(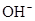 )
)D.两溶液中c(
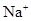 )、c(
)、c(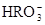 )、c(
)、c(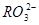 )分别相等
)分别相等维生素C又名抗坏血酸,易溶于水,易被氧化,能与碘反应。人体缺乏维生素C可能引发多种疾病。某研究性学习小组对它研究如下:
(1)猜想:维生素C可能具有酸性?
(2)实验方案:
提供试剂:维生素C片、蒸馏水、紫色石蕊试液、无色酚酞试液、稀盐酸、氢氧化钠溶液、氯化钡溶液、pH试纸。
根据以上试剂,请你帮助他们设计出实验方案,并写出实验现象:
| 实验内容 | 实验现象 |
| 方案Ⅰ:将维生素C片溶于蒸馏水配成溶液,向其中滴加石蕊试液 | |
| 方案Ⅱ: |
(3)结论:维生素C具有酸性。根据维生素C的性质,判断下列物质中能与维生素C反应的是__________。
A.金属镁 B.食盐 C.氢氧化钠 D.硫酸铜
(4)某同学联想到西红柿等蔬菜、水果中含有丰富的维生素C,放置时间长短是否对维生素C的含量产生影响。他设计了如下实验方案:
Ⅰ.把新鲜西红柿和放置一周的西红柿分别捣碎,用纱布将汁液挤入两个烧杯中;
Ⅱ.取两支盛有2 mL蓝色碘的淀粉溶液的试管,分别滴加上述两种汁液,边加边振荡,直到蓝色刚好消失,记录滴数如下:
| 汁液 | 新鲜西红柿的汁液 | 放置一周的西红柿的汁液 |
| 滴数 | 12 | 20 |
你认为西红柿中维生素C含量高的是__________。
查看习题详情和答案>>