摘要:3.下图甲.乙.丙.丁分别表示有关的生物学过程.在下列描述中.正确的是 ( ) A.甲中.若B点为茎背光侧的生长素浓度.则C点可能为向光侧浓度 B.乙中.施用农药后害虫种群的抗药基因的频率.C点比A点高 C.丙曲线表示胃蛋白酶催化蛋白质水解的催化特性 D.丁中苹果贮藏室的氧气应调整到A点对应的浓度
网址:http://m.1010jiajiao.com/timu3_id_375797[举报]
用下图所示的装置制取较多量的饱和氯水并探究饱和氯水的有关性质。

回答下列问题:
(1)写出装置丁中发生的化学反应方程式:_____________________。
(2)证明氯水已饱和的现象是________________。
(3)制取结束时,装置丙中的液体含有的微粒是________________(用微粒符号表示);
(4)测定饱和氯水的pH方法是____。若撤去装置乙,直接将装置甲和丙相连。这样做对实验测定结果的影响是____________________。
(5)饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一。如图所示:
(1)写出装置丁中发生的化学反应方程式:_____________________。
(2)证明氯水已饱和的现象是________________。
(3)制取结束时,装置丙中的液体含有的微粒是________________(用微粒符号表示);
(4)测定饱和氯水的pH方法是____。若撤去装置乙,直接将装置甲和丙相连。这样做对实验测定结果的影响是____________________。
(5)饱和氯水与石灰石反应是制取较浓HClO溶液的方法之一。如图所示:

Ⅰ在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液黄绿色褪去。
Ⅱ过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强。
Ⅲ为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2气体。
①能用饱和氯水与石灰石反应制备较浓HClO溶液的原因是____。
②依据上述实验可推知,Ⅱ的滤液中的溶质除CaCl2、HClO和极少量的氯气外,还含有_____________(写化学式)。
③写出步骤Ⅲ中,第二份滤液发生的离子反应方程式:____________________。
查看习题详情和答案>>
Ⅱ过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强。
Ⅲ为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生。经检测,上述实验中产生的无色气体均为CO2气体。
①能用饱和氯水与石灰石反应制备较浓HClO溶液的原因是____。
②依据上述实验可推知,Ⅱ的滤液中的溶质除CaCl2、HClO和极少量的氯气外,还含有_____________(写化学式)。
③写出步骤Ⅲ中,第二份滤液发生的离子反应方程式:____________________。
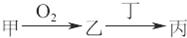 甲、乙、丙三种物质都含有A元素,只有甲是单质,其转化关系如图所示:
甲、乙、丙三种物质都含有A元素,只有甲是单质,其转化关系如图所示:(1)若乙是目前世界倡导需减少排放的温室气体,丁也含有A元素.则含有7个中子的核素A可用符号表示为
(2)若A是非金属元素,其次外层电子是最外层电子数的2倍,则乙在现代通讯中可用于制造
(3)若甲是生活中最常用的过渡金属单质,其在点燃条件与氧气反应生成乙.若丁是稀盐酸,则乙→丙的化学方程式为
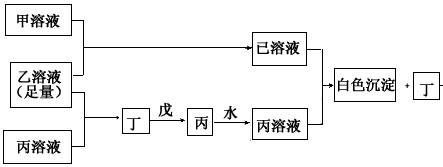
A、B、D是三种常见的短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数3个,是D元素原子最外层电子数的一半,A元素原子最外层电子数比B多一个。甲、乙、丙是三种最高价含氧酸的钠盐,甲中含B元素,乙中含D元素,丙中含A元素,甲、丙的水溶液均有较强的碱性,乙的水溶液pH小于7。丁为一种气体,戊为淡黄色固体。甲、乙、丙、丁、戊、已六种物质之间的相互反应关系如下图:(图中略去了物质转化时的部分生成物)
回答下列问题:
(1)写出A、B、D三种元素的元素名称_____________、_____________、_____________。
(2)写出戊的电子式_________________________。
(3)用电子式表示化合物AD2的过程____________________________。
(4)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生化学反应,但生成物不是已和丁,写出不足量的乙溶液分别和甲溶液、丙溶液反应时的离子反应方程式:
乙+甲______________________________;
乙+丙______________________________。
查看习题详情和答案>>
(1)写出A、B、D三种元素的元素名称_____________、_____________、_____________。
(2)写出戊的电子式_________________________。
(3)用电子式表示化合物AD2的过程____________________________。
(4)若乙溶液不足量,乙溶液分别和甲、丙溶液也能发生化学反应,但生成物不是已和丁,写出不足量的乙溶液分别和甲溶液、丙溶液反应时的离子反应方程式:
乙+甲______________________________;
乙+丙______________________________。
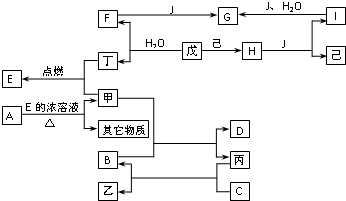 已知A、B、C、D、E、F、G、H、I、J是化合物,甲、已、丙、丁、戊、己是单质.其中,F、H、G、I焰色反应火焰呈黄色,B、C、D焰色反应透过钴玻璃观察火焰呈紫色,H是淡黄色固体.各物质间有如图所示的转化关系.
已知A、B、C、D、E、F、G、H、I、J是化合物,甲、已、丙、丁、戊、己是单质.其中,F、H、G、I焰色反应火焰呈黄色,B、C、D焰色反应透过钴玻璃观察火焰呈紫色,H是淡黄色固体.各物质间有如图所示的转化关系.(1)乙遇淀粉溶液变成蓝色,C物质的化学式是
(2)写出下列反应的方程式,是离子反应的写离子反应方程式:
I→G:
F+甲:
丙+C:
H+J:
(3)若A是一种钾盐,其水溶液显紫色.此时,A与E的浓溶液可反应制得甲,反应式可表示为:A+E→X+Y+甲+H2O,其中X、Y的化学式分别
在一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙、丙、丁 四个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热量(Q),及平衡时的转化率(X)如下表所示:
(1)下列说法一定正确的是
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)
②假设又向容器中加入一定量的SO3(g),X(SO2)
(3)平衡时,乙容器中SO2的体积分数为
(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).
①t2时改变的条件是
②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
则各平衡常数间的大小关系为
查看习题详情和答案>>
| 容器 | 起始时各物质的量 | 到达平衡时放出的热量(QkJ) | 平衡时SO2转化率 (X) | |||
| SO2(mol) | O2(mol) | SO3(mol) | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2=39.4 | X2 |
| 丙 | 1 | 0.5 | 0 | 1 | Q3 | X3 |
| 丁 | 1.8 | 0.9 | 0.2 | 0 | Q4 | X4 |
acdh
acdh
a、2Q3=2Q2<Q1<197kJ b、2X3=2X2<X1<100%
c、Q1>Q4 且 X1>X4 d、SO3的质量m:m甲=m丁>2m乙
e、容器内压强p:p甲=p丁>2p乙 f、c(SO2)与c(O2)之比k:k甲=k丙>k乙
h、若乙的体积为2L,则到达平衡时放出的热量小于39.4kJ
(2)某时刻甲容器内反应达到平衡,保持恒温恒容;
①假设又向容器内加入一定量的SO2气体,则X(SO2)
减小
减小
(填“增大”或“减小”),O2的浓度减小
减小
(填“增大”或“减小”)②假设又向容器中加入一定量的SO3(g),X(SO2)
减小
减小
(填“增大”或“减小”)(3)平衡时,乙容器中SO2的体积分数为
46
46
%(保留两位有效数字),该反应的平衡常数为1.5L?mol-1
1.5L?mol-1
(填具体值和单位,保留两位有效数字)(4)如图表示某一时间段中该反应反应速率与反应过程的关系(t2、t4、t5)时刻改变的条件都只有一个).

①t2时改变的条件是
升高温度
升高温度
;②若t5时降低压强,试画出t-v图象
③若各阶段对应的平衡常数如图所示
| t1-t2 | t3-t4 | t4-t5 | t6-t7 |
| K1 | K2 | K3 | K4 |
K1>K2=K3=K4
K1>K2=K3=K4
(由大到小排列)