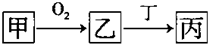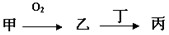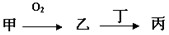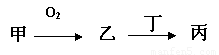��Ŀ����
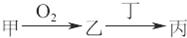 �ס��ҡ����������ʶ�����AԪ�أ�ֻ�м��ǵ��ʣ���ת����ϵ��ͼ��ʾ��
�ס��ҡ����������ʶ�����AԪ�أ�ֻ�м��ǵ��ʣ���ת����ϵ��ͼ��ʾ����1��������Ŀǰ���糫��������ŷŵ��������壬��Ҳ����AԪ�أ�����7�����ӵĺ���A���÷��ű�ʾΪ
��2����A�Ƿǽ���Ԫ�أ������������������������2�����������ִ�ͨѶ�п���������
��3����������������õĹ��ɽ������ʣ����ڵ�ȼ������������Ӧ�����ң�������ϡ���ᣬ���ҡ����Ļ�ѧ����ʽΪ
�������ס��ҡ����������ʶ�����AԪ�أ�ֻ�м��ǵ��ʣ�
��1��Ŀǰ�����ŷŵ���������ΪCO2����AԪ��Ϊ̼������CO2�����Ϊ̼����Ҳ����̼Ԫ�أ�����Һ�ʼ��ԣ��������̼��Ӧ���ɱ�����Ϊ̼���Σ���Ϊ̼�����Σ��ݴ˽��
��2��A�Ƿǽ���Ԫ�أ������������������������2�������ϸýṹ���ǹ裬������SiO2������ת����ϵ�������֪���������ֱ�ΪNaOH��Na2SiO3�����ݡ�ǿ�������ᡱԭ�����������������Һ��ͨ��CO2��ȡ�������֤����
��3����������������õĹ��ɽ������ʣ����ڵ�ȼ������������Ӧ�����ң��ý�������������Fe3O4����Fe3O4�����ᷴӦ����FeCl3��FeCl2��
��1��Ŀǰ�����ŷŵ���������ΪCO2����AԪ��Ϊ̼������CO2�����Ϊ̼����Ҳ����̼Ԫ�أ�����Һ�ʼ��ԣ��������̼��Ӧ���ɱ�����Ϊ̼���Σ���Ϊ̼�����Σ��ݴ˽��
��2��A�Ƿǽ���Ԫ�أ������������������������2�������ϸýṹ���ǹ裬������SiO2������ת����ϵ�������֪���������ֱ�ΪNaOH��Na2SiO3�����ݡ�ǿ�������ᡱԭ�����������������Һ��ͨ��CO2��ȡ�������֤����
��3����������������õĹ��ɽ������ʣ����ڵ�ȼ������������Ӧ�����ң��ý�������������Fe3O4����Fe3O4�����ᷴӦ����FeCl3��FeCl2��
����⣺�ס��ҡ����������ʶ�����AԪ�أ�ֻ�м��ǵ��ʣ�
��1��Ŀǰ�����ŷŵ���������ΪCO2����AԪ��Ϊ̼������CO2�����Ϊ̼����Ҳ����̼Ԫ�أ�����Һ�ʼ��ԣ��������̼��Ӧ���ɱ�����Ϊ̼���Σ���Ϊ̼�����Σ���
����7�����ӵĺ���A����������Ϊ6+7=15������ű�ʾΪ 136C��
̼������Һ�У�̼���ˮ��CO32-+H2O?HCO3-+OH-���ƻ�ˮ�ĵ���ƽ�⣬ʹ��Һ�ʼ��ԣ�
��֪���ڳ��³�ѹ�£�1mol̼��һ����̼�ֱ�������������Ӧ�ų��������ֱ���393.5kJ��283.0kJ����
��C��s��+O2��g��=CO2��g����H=-393.5kJ/mol��
��CO��g��+
O2��g��=CO2��g����H=-283.0kJ/mol��
���ݸ�˹���ɣ���-�ڡ�2��C��s��+CO2��g���T2CO��g����H=+172.5 kJ/mol
�ʴ�Ϊ��136C��CO32-+H2O?HCO3-+OH-��C��s��+CO2��g���T2CO��g����H=+172.5 kJ/mol��
��2��A�Ƿǽ���Ԫ�أ������������������������2�������ϸýṹ���ǹ裬������SiO2�����ִ�ͨѶ�п�����������ά������ת����ϵ�������֪���������ֱ�ΪNaOH��Na2SiO3�����ݡ�ǿ�������ᡱԭ�����������������Һ��ͨ��CO2��ȡ�������֤������Ӧ����ʽΪ��Na2SiO3+H2O+CO2�TH2SiO3��+Na2CO3��
�ʴ�Ϊ�����ά��Na2SiO3+H2O+CO2�TH2SiO3��+Na2CO3��
��3����������������õĹ��ɽ������ʣ����ڵ�ȼ������������Ӧ�����ң��ý�������������Fe3O4����Fe3O4�����ᷴӦ����FeCl3��FeCl2����Ӧ����ʽΪ��Fe3O4+8HCl�T2FeCl3+FeCl2+4H2O��
�ʴ�Ϊ��Fe3O4+8HCl�T2FeCl3+FeCl2+4H2O��
��1��Ŀǰ�����ŷŵ���������ΪCO2����AԪ��Ϊ̼������CO2�����Ϊ̼����Ҳ����̼Ԫ�أ�����Һ�ʼ��ԣ��������̼��Ӧ���ɱ�����Ϊ̼���Σ���Ϊ̼�����Σ���
����7�����ӵĺ���A����������Ϊ6+7=15������ű�ʾΪ 136C��
̼������Һ�У�̼���ˮ��CO32-+H2O?HCO3-+OH-���ƻ�ˮ�ĵ���ƽ�⣬ʹ��Һ�ʼ��ԣ�
��֪���ڳ��³�ѹ�£�1mol̼��һ����̼�ֱ�������������Ӧ�ų��������ֱ���393.5kJ��283.0kJ����
��C��s��+O2��g��=CO2��g����H=-393.5kJ/mol��
��CO��g��+
| 1 |
| 2 |
���ݸ�˹���ɣ���-�ڡ�2��C��s��+CO2��g���T2CO��g����H=+172.5 kJ/mol
�ʴ�Ϊ��136C��CO32-+H2O?HCO3-+OH-��C��s��+CO2��g���T2CO��g����H=+172.5 kJ/mol��
��2��A�Ƿǽ���Ԫ�أ������������������������2�������ϸýṹ���ǹ裬������SiO2�����ִ�ͨѶ�п�����������ά������ת����ϵ�������֪���������ֱ�ΪNaOH��Na2SiO3�����ݡ�ǿ�������ᡱԭ�����������������Һ��ͨ��CO2��ȡ�������֤������Ӧ����ʽΪ��Na2SiO3+H2O+CO2�TH2SiO3��+Na2CO3��
�ʴ�Ϊ�����ά��Na2SiO3+H2O+CO2�TH2SiO3��+Na2CO3��
��3����������������õĹ��ɽ������ʣ����ڵ�ȼ������������Ӧ�����ң��ý�������������Fe3O4����Fe3O4�����ᷴӦ����FeCl3��FeCl2����Ӧ����ʽΪ��Fe3O4+8HCl�T2FeCl3+FeCl2+4H2O��
�ʴ�Ϊ��Fe3O4+8HCl�T2FeCl3+FeCl2+4H2O��
���������⿼��������ƶϡ����û�ѧ������д�ȣ��Ѷ��еȣ��ƶ�Ԫ�ػ������ǽ���Ĺؼ�����1�����Ȼ�ѧ����ʽ����д��ע�����ø�˹���ɽ��

��ϰ��ϵ�д�
 �»ƸԱ����ܾ�ϵ�д�
�»ƸԱ����ܾ�ϵ�д�
�����Ŀ