摘要:⑴烧杯 漏斗 ⑵除去铁等不溶于碱的杂质 ⑶取上层清夜.逐滴加入稀硫酸.若变浑浊则说明沉淀不完全.若不变浑浊则说明沉淀完全 ⑷通入足量的CO2气体
网址:http://m.1010jiajiao.com/timu3_id_375645[举报]
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在,实验室里从海藻中提取碘的过程如图所示:

请填写下列空白:
(1)灼烧海藻时,除需要三脚架外,还需要用到的实验仪器是
A.烧杯 B.瓷坩埚 C.表面皿 D.泥三角 E.酒精灯 F.坩埚钳
(2)指出提取碘的过程中有关的实验操作名称:①
(3)提取碘的过程中,不能使用的有机溶剂是
A.酒精 B.苯 C.汽油
该提取操作通常在
(4)设计一个简单的实验,检验提取碘后的水溶液中是否还含有单质碘.请写出该实验的实验步骤、现象及结论
(5)“加碘食盐”中的碘主要以碘酸钾形式存在,其中碘元素的化合价是
测定“加碘食盐”中碘元素含量的一种方法如下:称取50.0g食盐溶于适量水,加入过量碘化钾和稀硫酸,其反应的化学方程式为:
①配平上述方程式,配平后的系数为:
②实验中,若测得生成3.0×10-5 mol I2,则该食盐中碘元素的含量是
查看习题详情和答案>>

请填写下列空白:
(1)灼烧海藻时,除需要三脚架外,还需要用到的实验仪器是
BDEF
BDEF
(从下列仪器中选出所需的仪器,用标号字母填写在空白处).A.烧杯 B.瓷坩埚 C.表面皿 D.泥三角 E.酒精灯 F.坩埚钳
(2)指出提取碘的过程中有关的实验操作名称:①
过滤
过滤
、②萃取(分液)
萃取(分液)
.(3)提取碘的过程中,不能使用的有机溶剂是
A
A
.其原因是酒精与水互溶
酒精与水互溶
.A.酒精 B.苯 C.汽油
该提取操作通常在
分液漏斗
分液漏斗
(仪器名称)中进行,若得到的是含碘的四氯化碳溶液,静置后分层,下层为紫(红)色
紫(红)色
色.(4)设计一个简单的实验,检验提取碘后的水溶液中是否还含有单质碘.请写出该实验的实验步骤、现象及结论
取少量提取液于试管中,滴加淀粉溶液,若溶液显蓝色,则说明原提取液中有碘单质
取少量提取液于试管中,滴加淀粉溶液,若溶液显蓝色,则说明原提取液中有碘单质
.(5)“加碘食盐”中的碘主要以碘酸钾形式存在,其中碘元素的化合价是
+5
+5
.测定“加碘食盐”中碘元素含量的一种方法如下:称取50.0g食盐溶于适量水,加入过量碘化钾和稀硫酸,其反应的化学方程式为:
1
1
KIO3+5
5
KI+3
3
H2SO4→3
3
K2SO4+3
3
I2+3
3
H2O①配平上述方程式,配平后的系数为:
1、5、3、3、3、3
1、5、3、3、3、3
.还原剂是KI
KI
.②实验中,若测得生成3.0×10-5 mol I2,则该食盐中碘元素的含量是
25.4
25.4
mg/kg.(精确至0.1)(2009?山东)孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物,实验室以孔雀石为原料制备CuSO4?5H2O及CaCO3,步骤如下:

请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+:从下列所给试剂中选择:实验步骤中试剂①为0
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4?5H2O,需要经过加热蒸发,
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应
查看习题详情和答案>>

请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+:从下列所给试剂中选择:实验步骤中试剂①为0
c
c
(填代号),检验溶液A中Fe3+的最佳试剂为d
d
(填代号).a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4?5H2O,需要经过加热蒸发,
冷却结晶
冷却结晶
,过滤等操作.除烧杯、漏斗外,过滤操作还用到另一玻璃仪器玻璃棒
玻璃棒
,该仪器在此操作中的主要作用是搅拌、引流
搅拌、引流
.(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)
NH3?H2O
NH3?H2O
(填化学式).若实验过程中有氨气逸出、应选用下列b
b
装置回收(填代号).
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应
与刻度线相平
与刻度线相平
,直到溶液凹液面最低处与刻度线相切
溶液凹液面最低处与刻度线相切
.用KMnO4标准溶液滴定时应选用酸式
酸式
滴定管(填“酸式”或“碱式”).印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用.
(1)测得某废腐蚀液中含CuCl2 1.5mol?L-1、FeCl23.0 mol?L-1、FeCl3 1.0mol?L-1、HCl3.0mol?L-1.取废腐蚀液200mL按如下流程在实验室进行实验:
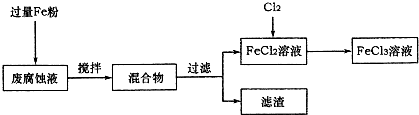
回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为
②检验废腐蚀液中含有Fe3+的实验操作是
在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、
③由滤渣得到纯铜,除杂所需试剂是
(2)某化学兴趣小组利用如图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.
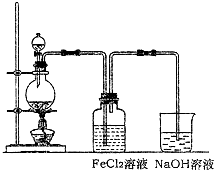
①实验开始前,某同学对实验装置进行了气密性检查,方法是
②浓盐酸与二氧化锰反应的化学方程式为
烧杯中NaOH溶液的作用是
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于
查看习题详情和答案>>
(1)测得某废腐蚀液中含CuCl2 1.5mol?L-1、FeCl23.0 mol?L-1、FeCl3 1.0mol?L-1、HCl3.0mol?L-1.取废腐蚀液200mL按如下流程在实验室进行实验:

回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑
2Fe3++Fe=3Fe2+、Cu2++Fe=Fe2++Cu、2H++Fe=Fe2++H2↑
;②检验废腐蚀液中含有Fe3+的实验操作是
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量废腐蚀液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
;在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、
漏斗
漏斗
.③由滤渣得到纯铜,除杂所需试剂是
盐酸
盐酸
.(2)某化学兴趣小组利用如图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液.

①实验开始前,某同学对实验装置进行了气密性检查,方法是
关闭分液漏斗活塞,将导管插入水中,用手捂热烧瓶,导管口有气泡冒出,松开手导管内出现一段水柱,证明气密性良好
关闭分液漏斗活塞,将导管插入水中,用手捂热烧瓶,导管口有气泡冒出,松开手导管内出现一段水柱,证明气密性良好
.②浓盐酸与二氧化锰反应的化学方程式为
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
;
| ||
烧杯中NaOH溶液的作用是
吸收多余氯气,防止尾气处理
吸收多余氯气,防止尾气处理
.③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于
39.2
39.2
g,需通入Cl2的物质的量应不少于0.75
0.75
mol.孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4?5H2O及纳米材料G,步骤如图所示:
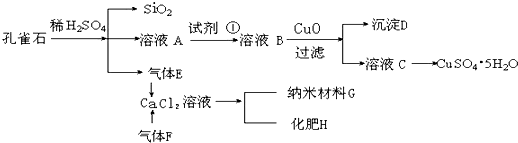
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+.从下列所给试剂中选择:实验步骤中试剂①最佳为
a.KMnO4/H+ b.Cl2 c.H2O2 d.KSCN
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为
(2)由溶液C获得CuSO4?5H2O,需要经过
(3)制备纳米材料G时,应向CaCl2溶液中选通入(或先加入)
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用
查看习题详情和答案>>

请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+.从下列所给试剂中选择:实验步骤中试剂①最佳为
c
c
(填代号),检验溶液A中Fe3+的最佳试剂为d
d
(填代号).a.KMnO4/H+ b.Cl2 c.H2O2 d.KSCN
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为
Fe(OH)3
Fe(OH)3
,加入CuO作用是调节溶液pH值,使Fe3+的水解生成氢氧化铁沉淀而除去
调节溶液pH值,使Fe3+的水解生成氢氧化铁沉淀而除去
.(2)由溶液C获得CuSO4?5H2O,需要经过
蒸发、冷却结晶、过滤
蒸发、冷却结晶、过滤
操作.除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是引流
引流
.(3)制备纳米材料G时,应向CaCl2溶液中选通入(或先加入)
NH3
NH3
(填化学式).写出该反应的化学方程式2NH3+CO2+CaCl2+H2O=CaCO3+2NH4Cl
2NH3+CO2+CaCl2+H2O=CaCO3+2NH4Cl
.(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用
酸式滴定管
酸式滴定管
.取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为溶液变成紫红色并保持半分钟内不褪色
溶液变成紫红色并保持半分钟内不褪色
.