网址:http://m.1010jiajiao.com/timu3_id_375283[举报]
(6分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g)2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
该反应的△H 0(填“>”、“=”或“<”)。
(2)2404℃时,在容积为1.0L的密闭容器中通入2.6molN2和2.6mol O2,计算反应:
N2(g)+O2(g)2NO(g)达到平衡时N2的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
(3)科学家一直致力于研究常温常压下“人工固氮”的新方法。曾有实验报道:在常温、常压光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1)=4NH3 (g)+3O2(g) DH=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热DH= 。 (用含a的代数式表示)
查看习题详情和答案>>
(6分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g) 2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
(2)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应:
N2(g)+O2(g)
 2NO(g)达到平衡时N2的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时N2的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)(3)科学家一直致力于研究常温常压下“人工固氮”的新方法。曾有实验报道:在常温、常压光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1)=4NH3 (g)+3O2(g) DH=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热DH= 。 (用含a的代数式表示) 查看习题详情和答案>>
(6分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g) 2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
|
温度/℃ |
1538 |
1760 |
2404 |
|
平衡常数K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
该反应的△H 0(填“>”、“=”或“<”)。
(2)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应:
N2(g)+O2(g)
 2NO(g)达到平衡时N2的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时N2的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
(3)科学家一直致力于研究常温常压下“人工固氮”的新方法。曾有实验报道:在常温、常压光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1)=4NH3 (g)+3O2(g) DH=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热DH= 。 (用含a的代数式表示)
查看习题详情和答案>>
(1)在不同温度下,反应N2(g)+O2(g)
 2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
2NO(g) DH=a kJ·mol-1的平衡常数K如下表:| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
(2)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应:
N2(g)+O2(g)
 2NO(g)达到平衡时N2的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时N2的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)(3)科学家一直致力于研究常温常压下“人工固氮”的新方法。曾有实验报道:在常温、常压光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1)=4NH3 (g)+3O2(g) DH=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热DH= 。 (用含a的代数式表示)
(1)在不同温度下,反应N2(g)+O2(g)?2NO(g)△H=a kJ?mol-1的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
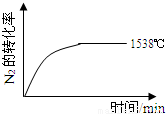
②其他条件相同时,在上述三个温度下分别发生该反应.
1538℃时,N2的转化率随时间变化如图所示,请补充完成1760℃时N2的转化率随时间变化的示意图.
(2)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应N2(g)+O2(g)?2NO(g)达到平衡时NO的浓度.(此温度下不考虑O2与NO的反应.计算结果保留两位有效数字)
(3)科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.相应的热化学方程式如下:
2N2(g)+6H2O(1)=4NH3(g)+3O2(g)△H=+1530kJ?mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热△H= .(用含a的代数式表示)
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定--氨的电解法合成,大大提高了氮气和氢气的转化率.总反应式为:N2+3H2?2NH3.则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、“阴”或“阳”);在另一电极通入N2,该电极反应式为 .
 查看习题详情和答案>>
查看习题详情和答案>>