题目内容
(6分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)在不同温度下,反应N2(g)+O2(g)2NO(g) DH=a kJ·mol-1的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
该反应的△H 0(填“>”、“=”或“<”)。
(2)2404℃时,在容积为1.0L的密闭容器中通入2.6molN2和2.6mol O2,计算反应:
N2(g)+O2(g)2NO(g)达到平衡时N2的浓度为 。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
(3)科学家一直致力于研究常温常压下“人工固氮”的新方法。曾有实验报道:在常温、常压光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。相应的热化学方程式如下:
2N2(g)+6H2O(1)=4NH3 (g)+3O2(g) DH=+1530kJ·mol-1
则氨催化氧化反应4NH3(g)+5O2(g)=4NO(g)+6H2O(1)的反应热DH= 。 (用含a的代数式表示)
(1)> (2)2.5mol/L (3)(2a-1530)kJ·mol-
解析:(1)根据表中数据可知,升高温度,平衡常数增大,所以反应是吸热反应,即△H>0.
(2) N2(g)+O2(g)2NO(g)
起始量(mol) 2.6 2.6 0
转化量(mol) x x 2x
平衡量(mol) 2.6-x 2.6-x 2x
根据该温度下的平衡常数可知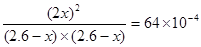
解得x=0.1mol,所以平衡时氮气的浓度为![]()
(3)考查盖斯定律的应用。将反应①N2(g)+O2(g)2NO(g) DH=a kJ·mol-1和反应②2N2(g)+6H2O(1)=4NH3 (g)+3O2(g) DH=+1530kJ·mol-1叠加,即①×2-②得到4NH3(g)+5O2(g)=4NO(g)+6H2O(1),所以其反应热是(2a-1530)kJ·mol-。

自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g) 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
(填“>”、“=”或“<”)
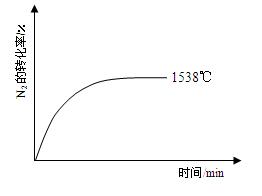
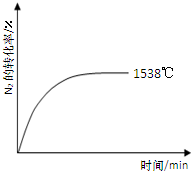
②其他条件相同时,在上述三个温度下分别发生该反应。1538℃时,N2的转化率随时间变化如右图所示,请补充完成1760℃、2404℃时N2的转化率随时间变化的示意图。
(3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应
N2(g)+O2(g)
 2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字) (Ⅰ)(4分)自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO。
(1)反应需要在闪电或极高温条件下发生,说明该反应_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同温度下,反应N2(g)+O2(g)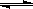 2NO(g)的平衡常数K如下表:
2NO(g)的平衡常数K如下表:
|
温度/℃ |
1538 |
1760 |
2404 |
|
平衡常数K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
该反应的△H 0。(填“>”、“=”或“<”)
(3)2404℃时,在容积为1.0L的密闭容器中通入2.6mol N2和2.6mol O2,计算反应N2(g)+O2(g)  2NO(g)达到平衡时NO的浓度为
。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
2NO(g)达到平衡时NO的浓度为
。(此温度下不考虑O2与NO的反应。计算结果保留两位有效数字)
(Ⅱ)(5分)在容积为1L的密闭容器中,进行如下反应:A(g)+2B(g)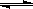 C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
C(g)+D(g),不同温度下,D的物质的量n(D)和时间t的关系如图。试回答下列问题:
(1)能判断该反应达到化学平衡状态的依据是 。
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(2)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数
K= ,该反应为 反应(填吸热或放热)
(3)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应 进行(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO. 自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.
自然界里氮的固定途径之一是在闪电的作用下,N2与O2反应生成NO.