网址:http://m.1010jiajiao.com/timu3_id_375281[举报]
2Na2O2+2CO2═2Na2CO3+O2 2Na2O2+2H2O=4NaOH+O2↑
然而,过氧化钠与其他非金属氧化物(如:NO、NO2等)的反应能否发生呢?为此,某校化学兴趣小组设计了以下实验进行探究:
步骤一:NO、NO2的制备
①本实验所用的NO由饱和硫酸亚铁溶液与浓硫酸和粉末状硝酸钾反应制备,在酸性环境中硝酸根离子被还原为NO,得到的NO的纯度约为98%;
反应的化学方程式为:
②NO2由硝酸铅受热分解得到:2Pb(NO3)2=2PbO+4NO2↑+O2↑使生成的气体通过
A.装有H2O的洗气瓶 B.置于冰水中的U形管(NO2沸点21℃)
C.装有浓硫酸的洗气瓶 D.装有Na2SO3溶液的洗气瓶
步骤二:操作(如图,b、c为弹簧夹)
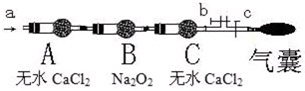
①先打开b关闭c,通入
A.空气 B.O2C.CO2 D.N2
②然后
现象:当通入NO时,B中靠近A侧浅黄色固体变成黄色,气囊未见鼓起;当通入NO2时,B中靠近A侧浅黄色固体变成白色,气囊也未见鼓起;
步骤三:产物检验
分别取出B中黄色固体或白色固体进行检验,得知两种固体均为盐.
结论:
请写出NO2与 Na2O2反应的化学方程式:
(1)下表是硝酸与某种金属M在某些条件下反应所得还原产物的关系:
| 硝酸 | 硝酸浓度大于10mol/L | 硝酸浓度为6.6~10mol/L、加热 | 硝酸浓度为6.6~10mol/L |
| 还原产物 | NO2 | NO2 | NO2 |
| 硝酸 | 硝酸浓度为0.1~6.6mol/L、加热 | 硝酸浓度0.1~6.6mol/L | 硝酸浓度0.1mol/L |
| 还原产物 | NO | NO2、N2 | NH4NO3 |
(2)以氨作为燃料的固体氧化物(含 有02-)燃料电池,具有全固态 结构、能量效率高、无污染等特 点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很 好的氢源载体.其工作原理如图1 所示,
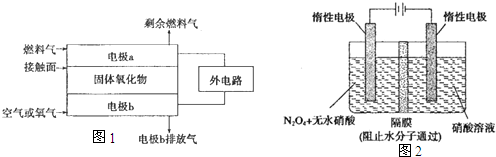
①该电池工作时的总反应为
②固体氧化物作为电池工作的电解质,O2-移动方向为
③该电池工作时,在接触面上发生的电极反应为
(3)N2O5是一种新型硝化剂,其性质和制备 受到人们的关注.如图2所示装置可用于制备N2O5,写出在电解池中生成N205 的电极反应式

(1)图1是1molNO2和1mol CO反应生成CO2和NO过程中能星变化示意图(a、b均大 于0>,且知:
2CO(g)+2NO(g)=N2(g)+2CO2(g)△H=-ckJ?mol-1(c>0)
请写出CO将NO2还原至N2时的热化学方程式
(2)图2是实验室在三个不同条件的密闭容器中合成氨时,N2的浓度随时间的变化曲线(以a、b、c表示).已知三个条件下起始加入浓度均为:c(N2)=0.1mol?L-1,c(H2)=0.3mol?L-1;合成氨的反应:N2(g)+3H2(g)?2NH3(g)△H<0
①计算在a达平衡时H2的转化率为
②由图2可知,b、c各有一个条件与a不同,则c的条件改变可能是
(3)利用图2中c条件下合成氨(容积固定).已知化学平衡常数K与温度(T)的关系如 下表:
| T/(K) | 298 | 398 | 498 | … |
| K/(mol?L-1)-2 | 4.1×106 | K1 | K2 | … |
②下列各项能作为判断该反应达到化学平衡状态的依据的是
A.容器内NH3的浓度保持不变 B.2v( N2)(正)-v( H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(4)①NH4Cl溶液呈酸性的原因是(用离子反应方程式表示)
②25°C时,将PH=x氨水与pH=y的疏酸(且x+y-14,x>11 )等体积混合后,所得溶液 中各种离子的浓度关系正确的是
A.[SO
2- 4 |
+ 4 |
B.[NH
+ 4 |
2- 4 |
C.[NH
+ 4 |
2- 4 |
D.[NH
+ 4 |
2- 4 |

(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B 乙:A→B→C→E 丙:A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不能”):
甲:_______________;乙:_______________;丙:_______________。
具体说明不能验证的主要原因(能验证的方案,不必回答原因):
甲方案:______________________________________________________________。
乙方案:______________________________________________________________。
丙方案:______________________________________________________________。
(2)实验开始时首先通入足量的N2,其目的是____________________________________。
(3)确认气体中含NO的现象是_________________________________________________。
(4)如果O2过量,则装置B中发生反应的离子方程式是______________________________。
查看习题详情和答案>>随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
(1) 用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g) =4NO(g) + CO2(g) +2H2O(g) ⊿H= -574 kJ·mol-1
②CH4(g) +4NO(g) =2N2(g) + CO2(g) + 2H2O(g) ⊿H= -1160 kJ·mol-1
③H2O(g) = H2O(l) △H= -44.0 kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式 。
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理。已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
(3)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g) N2
(g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2
(g)+CO2 (g) 。某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
|
|
NO |
N2 |
CO2 |
|
0 |
1.00 |
0 |
0 |
|
10 |
0.58 |
0.21 |
0.21 |
|
20 |
0.40 |
0.30 |
0.30 |
|
30 |
0.40 |
0.30 |
0.30 |
|
40 |
0.32 |
0.34 |
0.17 |
|
50 |
0.32 |
0.34 |
0.17 |
①10min~20min以v(CO2) 表示的反应速率为 。
②根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数)。
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”、“不变”或“减小”) 。
④下列各项能作为判断该反应达到平衡的是 (填序号字母)。
A.容器内压强保持不变 B. 2v正(NO) = v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是 。请在下图中画出30min至40min 的变化曲线。

查看习题详情和答案>>
 浓度/mol·L-1
浓度/mol·L-1 时间/min
时间/min