摘要:中国有句农谚.叫“雷雨发庄稼 .其中蕴含着丰富的科学知识.用化学方程式表示: ________._____________._____________.
网址:http://m.1010jiajiao.com/timu3_id_375269[举报]
“中东有石油,中国有稀土”.稀土金属是我国战略性资源应加以保护,它们是周期表中ⅢB族钪、钇和镧系一类元素的总称,都是很活泼的金属,性质极为相似,常见化合价为+3价.
Ⅰ.钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
②在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似.
(1)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则最好选用盐酸、 (填字母)两种试剂,再通过必要的操作即可实现.
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
(2)流程图中用氨水调节pH=a时生成沉淀的化学式为 ,继续加氨水调至pH=b,此时发生反应的离子方程式为 ;
(3)沉淀C为草酸钇,写出草酸钇隔绝空气加热生成Y2O3的化学方程式 ;
Ⅱ.镧系元素铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解.
(4)无水CeCl3可用加热CeCl3?6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是 ;
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
Ce3++ H2O2+ H2O→ Ce(OH)4↓+ .
查看习题详情和答案>>
Ⅰ.钇(Y)元素是激光和超导的重要材料.我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:

已知:①有关金属离子形成氢氧化物沉淀时的pH如下表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
(1)欲从Na2SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀.则最好选用盐酸、
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
(2)流程图中用氨水调节pH=a时生成沉淀的化学式为
(3)沉淀C为草酸钇,写出草酸钇隔绝空气加热生成Y2O3的化学方程式
Ⅱ.镧系元素铈(Ce)是地壳中含量最高的稀土元素.在加热条件下CeCl3易发生水解.
(4)无水CeCl3可用加热CeCl3?6H2O和NH4Cl固体混合物的方法来制备.其中NH4Cl的作用是
(5)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离.完成反应的离子方程式:
下列叙述中,正确的是( )
①蛋白质溶液加入K2SO4溶液后,蛋白质从溶液中析出,这种变化叫变性②油脂水解后得到的是醇是丙三醇③天然蛋白质水解的最后产物是多种α-氨基酸④淀粉、纤维素、油脂都是高分子化合物.
①蛋白质溶液加入K2SO4溶液后,蛋白质从溶液中析出,这种变化叫变性②油脂水解后得到的是醇是丙三醇③天然蛋白质水解的最后产物是多种α-氨基酸④淀粉、纤维素、油脂都是高分子化合物.
查看习题详情和答案>>
在氮的化合物中,有一类盐叫亚硝酸盐.如亚硝酸钠(NaNO2)等.它们广泛用于印染、漂白等行业,在建筑行业用作防冻剂,在食品工业作防腐剂和增色剂;它是一种潜在致癌物质,过量或长期食用对人产生危害,由于亚硝酸钠有咸味,外观与NaCl相似,曾多次发生过被误当食盐食用的事件.
某同学查阅有关资料,了解到以下相关信息:
亚硝酸及亚硝酸盐的资料:
(1)HNO2是一种弱酸(比醋酸略强),且不稳定,易分解生成NO和NO2
(2)HNO2能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把氧化成I2
(3)AgNO2种难溶于水易溶于酸的化合物
(4)NaNO2制备:
2NaOH+NO+NO2═2NaNO2+H2O
2NO2+2NaOH═NaNO3+NaNO2+H2O
2NaNO3
2NaNO2+O2↑
试回答下列问题:
(1)人体正常的血红蛋白中应含Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是 .
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(2)下列方法中,不能用来区别NaNO2和NaCl的是 .
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
D.分别在这两种溶液中滴加甲基橙
(3)为了测定某样品中NaNO2的含量,可以使用标准KMnO4溶液进行滴定,试回答:
①KMnO4溶液在滴定过程中作 (填“氧化剂”“还原剂”),该滴定过程 (填“要”或“不要”)另加指示剂.
②若滴定终点读数时目光俯视,则所得结果 (填“偏大”“偏小”“无影响”).
(4)某同学在家中欲进行鉴别NaCl与NaNO2的实验,但他家中只有浓醋酸,请问该实验能否成功?说明理由.
(5)现有氮的三种常见氧化物组成的混和气体44.8L(体积已换算成标准状态),其中N2O4、NO体积分数都为20%.
①将该气体通入适量的NaOH溶液中恰好反应,则溶液中NaNO2的质量是 g;
②反应后的溶液蒸干灼烧则NaNO2物质的量 mol.
查看习题详情和答案>>
某同学查阅有关资料,了解到以下相关信息:
亚硝酸及亚硝酸盐的资料:
(1)HNO2是一种弱酸(比醋酸略强),且不稳定,易分解生成NO和NO2
(2)HNO2能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把氧化成I2
(3)AgNO2种难溶于水易溶于酸的化合物
(4)NaNO2制备:
2NaOH+NO+NO2═2NaNO2+H2O
2NO2+2NaOH═NaNO3+NaNO2+H2O
2NaNO3
| ||
试回答下列问题:
(1)人体正常的血红蛋白中应含Fe2+.若误食亚硝酸盐(如NaNO2),则导致血红蛋白中Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是
A.亚硝酸盐是还原剂 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐被还原
(2)下列方法中,不能用来区别NaNO2和NaCl的是
A.测定这两种溶液的pH
B.用AgNO3和HNO3两种试剂来区别
C.在酸性条件下加入KI淀粉试液来区别
D.分别在这两种溶液中滴加甲基橙
(3)为了测定某样品中NaNO2的含量,可以使用标准KMnO4溶液进行滴定,试回答:
①KMnO4溶液在滴定过程中作
②若滴定终点读数时目光俯视,则所得结果
(4)某同学在家中欲进行鉴别NaCl与NaNO2的实验,但他家中只有浓醋酸,请问该实验能否成功?说明理由.
(5)现有氮的三种常见氧化物组成的混和气体44.8L(体积已换算成标准状态),其中N2O4、NO体积分数都为20%.
①将该气体通入适量的NaOH溶液中恰好反应,则溶液中NaNO2的质量是
②反应后的溶液蒸干灼烧则NaNO2物质的量
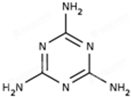 2008年震惊我国的“毒奶粉”事件,是奶粉中掺有一种叫三聚氰胺的物质(分子结构如图),其分子式为C3N6H6,是一种白色无味的晶体.下列有关三聚氰胺的说法不正确的是( )
2008年震惊我国的“毒奶粉”事件,是奶粉中掺有一种叫三聚氰胺的物质(分子结构如图),其分子式为C3N6H6,是一种白色无味的晶体.下列有关三聚氰胺的说法不正确的是( )| A、它是一种含氮的有机化合物,所有碳原子都采用sp2杂化 | B、它的相对分子质量为126g/mol | C、它易溶于苯、四氯化碳等有机溶剂 | D、由于它的含氮量高,被不法商人添加到奶粉中,以提升奶粉检测中的蛋白质含量指标 |