网址:http://m.1010jiajiao.com/timu3_id_375268[举报]
 二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.
二氧化硫和氯气是中学化学中的常见气体,探究二者的制法和性质是十分重要的课题.(1)实验室可由多种途径制取SO2.
途径Ⅰ:Na2SO3固体与较浓的硫酸(约70%)反应制取;
途径Ⅱ:铜与浓硫酸加热制取.
如果要在实验室制取SO2,选用上述两种方法中的
(2)如图是用KMnO4与浓盐酸反应制取适量氯气的简易装置.
已知:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
装置B、C、D的作用分别是:
B

C
D
(3)某同学设计用如下装置探究二氧化硫、氯气的化学性质.
通过控制弹簧夹a、b,向装置A中分别通入不同气体,请完成如下问题:
①若关闭b,打开a,若X为品红溶液,则A中的现象为:
②若关闭a,打开b,若X为紫色石蕊试液,则A中的现象为:
③若同时打开a、b,且通入的气体体积比为1:1,若X为紫色石蕊试液,则A中的现象为
二氧化硫是一种大气污染物,研究对NO2、SO2、CO等大气污染气体的处理有重要意义,某化学实验爱好小组欲探究SO2的性质,设计如下方案:

(1)B、C、D分别用于检验SO2的还原性、氧化性和漂白性。其中B、C分别为碘水和硫化氢的水溶液,则D中所盛试剂为_________,B中反应的离子方程式为:_________________。
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:________________________________(任写一点即可)。
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。
请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
|
实验操作 |
预期现象与结论 |
|
步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 |
若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
|
步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 ___________________________________________________ |
_________________________ ______________________________________________ |
|
步骤3:_______ _______________________ ___________________________________________________ |
_________________________
|
查看习题详情和答案>>
二氧化硫
1)二氧化硫与水的反应,水溶液的酸碱性,二氧化硫或亚硫酸的漂白性实验:
|
实验操作 |
现象 |
结论 |
|
(1)把盛有SO2的试管倒立于水中,打开胶塞 |
试管内液面 。 |
SO2 溶于水。 |
|
(2)用pH试纸测定溶液的酸碱度 |
|
_________溶液呈 性。 |
|
(3)滴入2滴品红溶液,振荡;加热试管,再观察 |
; 。 |
|
【思考】分别从化合价的角度,作为酸性氧化物的角度,二氧化硫有什么化学性质:__________________________________________________________
(1)SO2与水的反应方程式为______________________。
(2)SO2与NaOH溶液的反应方程式为______________________。另举两例反应酸性氧化物这一通性的化学反应:_____ ____________ _____,_____________。
(3)SO2与O2的反应——二氧化硫表现____________性,反应方程式为_____________________。
【思考】二氧化碳与二氧化硫的鉴别
①利用二氧化硫的还原性,用高锰酸钾溶液或溴水褪色鉴别。
②利用二氧化硫的漂白性,用品红溶液鉴别。
【思考】硫酸酸雨如何形成?写出反应的方程式
__________________________________________________________________
(4)SO2或亚硫酸有漂白性:二氧化硫或亚硫酸有漂白作用,与有色物质发生化合反应,生成不稳定的无色物质,加热又恢复为原来的颜色。利用品红溶液可检验二氧化硫气体。】
SO2可与CaO等碱性氧化物反应:SO2 + CaO —— 。
2)SO2既有 性,又有 性,但 相对较强。
SO2通入溴水中使溴水褪色,表现出SO2的 性;SO2可以和氧气反应:SO2 + O2 —— 。体现出SO2的 性。
在反应2H2S + SO2 =" 3S" + 2H2O 中表现了SO2的 性。
3)SO2有 性,能使 褪色。
工业上常用SO2来漂白 。
SO2的漂白作用与次氯酸的漂白作用相不相同? 。SO2的漂白作用稳不稳定? 。而次氯酸的漂白过程是发生了 反应,其漂白作用是永久性的。【思考】常见具有漂白剂有那些?原理有何区别?
查看习题详情和答案>>
二氧化硫是一种大气污染物,研究对NO2、SO2、CO等大气污染气体的处理有重要意义,某化学实验爱好小组欲探究SO2的性质,设计如下方案: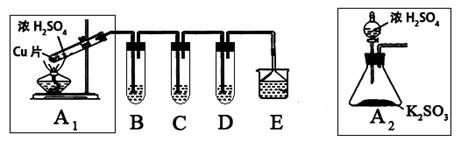
(1)B、C、D分别用于检验SO2的还原性、氧化性和漂白性。其中B、C分别为碘水和硫化氢的水溶液,则D中所盛试剂为_________,B中反应的离子方程式为:_________________。
(2)为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:________________________________(任写一点即可)。
(3)E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。
请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体 ___________________________________________________ | _________________________ ______________________________________________ |
| 步骤3:_______ _______________________ ___________________________________________________ | _________________________ |
二氧化硫是一种无色、有刺激性气味的气体。空气中二氧化硫的浓度只有百万分之一时,我们就会感到胸部有一种被压迫的不适感。当浓度达到百万分之八时,人就会感到呼吸困难。二氧化硫的危害还在于它常常跟大气中的飘尘结合在一起,进入人和其他动物的肺部,或在高空中与水蒸气结合成酸雨而降落下来,对人和其他动植物造成危害。目前,我国的能源结构主要以煤为主,因此,我国的大气污染是以烟尘和二氧化硫为代表的典型的煤烟型污染。1989年,科学研究人员对北京的两个居民区进行了大气污染与死亡率的关系研究。研究结果表明,大气中二氧化硫的浓度每增加1倍,总死亡率就增加11%。所以我们要时刻警惕二氧化硫污染。
据统计,世界各国每年排入大气中的二氧化硫的总量达1.5亿吨以上,而且呈逐年上升趋势。这些二氧化硫主要是过度燃烧煤和石油生成的。中国是燃煤大国,随着燃煤量的增加,排放的二氧化硫的量也不断增加。二氧化硫的大量排放使城市的空气污染不断加重,并导致我国出现大面积的酸雨。我国的酸雨主要是硫酸型的,要治理酸雨污染,就要控制二氧化硫的排放量。
为了保护环境,变废为宝,我们可以采用多种方法进行烟道气脱硫,以防止空气污染并回收和利用二氧化硫。
方法一:冶金厂利用一氧化碳还原二氧化硫。
SO2+2CO
 S+2CO2
S+2CO2方法二:硫酸厂通常用氨水吸收二氧化硫。
SO2+2NH3+H2O=(NH4)2SO3
(NH4)2SO3+SO2+H2O=2NH4HSO3
当吸收液达到一定浓度时,再用质量分数为93%的浓硫酸酸化:
2NH4HSO3+H2SO4(浓)=(NH4)2SO4+2SO2↑+2H2O
(NH4)2SO3+H2SO4(浓)=(NH4)2SO4+SO2↑+H2O
放出的二氧化硫经液化得到液态二氧化硫,可用于制取漂白剂、消毒剂,也可用于生产硫酸(前苏联曾用烟道气生产了百万吨硫酸)。硫酸铵溶液经过结晶、分离、干燥,可用于制化肥(硫铵)。
方法三:用纯碱溶液吸收二氧化硫。
2Na2CO3+SO2+H2O=2NaHCO3+Na2SO3
2NaHCO3+SO2=Na2SO3+2CO2+H2O
Na2SO3+SO2+H2O=2NaHSO3
方法四:用石灰水处理低浓度的二氧化硫烟道气也具有重要的意义。
其原理是将烟道气经水洗、冷却、除尘后,在吸收塔内用质量分数为10%的石灰乳浆吸收,再将吸收后的浆液用加压空气氧化,生成石膏。缺少石膏的日本、美国、瑞典大都采用此法处理烟道气。
思考题:
1.上述处理和回收二氧化硫的措施分别利用了SO2的什么性质?
2.你能写出方法四的化学方程式吗? 查看习题详情和答案>>