题目内容
二氧化硫
1)二氧化硫与水的反应,水溶液的酸碱性,二氧化硫或亚硫酸的漂白性实验:
|
实验操作 |
现象 |
结论 |
|
(1)把盛有SO2的试管倒立于水中,打开胶塞 |
试管内液面 。 |
SO2 溶于水。 |
|
(2)用pH试纸测定溶液的酸碱度 |
|
_________溶液呈 性。 |
|
(3)滴入2滴品红溶液,振荡;加热试管,再观察 |
; 。 |
|
【思考】分别从化合价的角度,作为酸性氧化物的角度,二氧化硫有什么化学性质:__________________________________________________________
(1)SO2与水的反应方程式为______________________。
(2)SO2与NaOH溶液的反应方程式为______________________。另举两例反应酸性氧化物这一通性的化学反应:_____ ____________ _____,_____________。
(3)SO2与O2的反应——二氧化硫表现____________性,反应方程式为_____________________。
【思考】二氧化碳与二氧化硫的鉴别
①利用二氧化硫的还原性,用高锰酸钾溶液或溴水褪色鉴别。
②利用二氧化硫的漂白性,用品红溶液鉴别。
【思考】硫酸酸雨如何形成?写出反应的方程式
__________________________________________________________________
(4)SO2或亚硫酸有漂白性:二氧化硫或亚硫酸有漂白作用,与有色物质发生化合反应,生成不稳定的无色物质,加热又恢复为原来的颜色。利用品红溶液可检验二氧化硫气体。】
SO2可与CaO等碱性氧化物反应:SO2 + CaO —— 。
2)SO2既有 性,又有 性,但 相对较强。
SO2通入溴水中使溴水褪色,表现出SO2的 性;SO2可以和氧气反应:SO2 + O2 —— 。体现出SO2的 性。
在反应2H2S + SO2 =" 3S" + 2H2O 中表现了SO2的 性。
3)SO2有 性,能使 褪色。
工业上常用SO2来漂白 。
SO2的漂白作用与次氯酸的漂白作用相不相同? 。SO2的漂白作用稳不稳定? 。而次氯酸的漂白过程是发生了 反应,其漂白作用是永久性的。【思考】常见具有漂白剂有那些?原理有何区别?
1)
|
实验操作 |
现象 |
结论 |
|
(1)把盛有SO2的试管倒立于水中,打开胶塞 |
试管内液面 上升 。 |
SO2 易 溶于水。 |
|
(2)用pH试纸测定溶液的酸碱度 |
pH试纸显红色 |
二氧化硫的水溶液呈酸性。 |
|
(3)滴入2滴品红溶液,振荡;加热试管,再观察 |
滴入品红溶液,溶液褪色;加热后溶液又显红色。 |
二氧化硫检验漂泊性;二氧化硫的漂白是不稳定的,加热后又恢复原来的颜色。 |
氧化性、还原性;酸性氧化物的通性
(1)SO2+H2O H2SO3;
H2SO3;
(2)SO2+2NaOH=Na2SO3+H2O;CO2+2NaOH=Na2CO3+H2O;SiO2+2NaOH=Na2SiO3+H2O
(3)还原性;2SO2+O2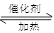 2SO3;SO2+H2O
2SO3;SO2+H2O H2SO3;2H2SO3+O2=2H2SO4;
H2SO3;2H2SO3+O2=2H2SO4;
(4)SO2+CaO=CaSO3。
2)氧化性、还原性、还原性、还原性、还原性、氧化性
3)漂泊性;品红溶液;有色纸浆和草帽等;本相同;不稳定;氧化还原反应
1.与有机色素结合成不稳定的无色物质。SO2漂白性的实质是 SO2与水反应生成的H2SO3跟有机色素结合成了不稳定的无色化合物,该化合物见光、遇热或长久放置又能恢复为原来的颜色。SO2漂白原理属于非氧化—还原反应。2.氧化性漂白:漂白剂具有氧化性,将有机色素氧化成稳定的无色物质。(1)氯水、Ca(ClO)2的漂白性:干燥的氯气不能使红布条褪色,而能使湿润的红布条褪色,证明起漂白作用的不是 Cl2,而是 HClO。氯气也能使品红溶液褪色,但加热不能复原,其实质为氧化还原反应。Ca(ClO)2在水中极易发生水解,或与CO2反应生成 HClO,从而表现出漂白性。(2)H2O2、Na2O2的漂白性:过氧化氢在常温下能自动分解:2H2O2=2H2O+O2↑,因此它是一种强氧化剂,纺织工业常用它作漂白剂,就是利用它的氧化性。Na2O2是一种淡黄色晶体,与水或者稀酸作用时,生成过氧化氢,并猛烈放热。生成的 H2O2在受热情况下立即分解放出氧气,表现出强氧化性:2Na2O2+2H2O=4NaOH+O2↑。因此Na2O2是一种重要的工业漂白剂。(3)臭氧的漂白性:O3分子是不稳定的,氧化能力远比O2强,且在水溶液中具有强氧化性。所以当有水存在时,O3是一种强力漂白剂,还用于水和空气的消毒。3.吸附性漂白:木炭、活性炭具有疏松多孔的结构,形成较大的比表面积,具有很强的吸附性。
【解析】
试题分析:SO2是一种酸性氧化物,易溶于水,生成亚硫酸,具有酸性氧化物的通性。由于SO2中S元素的化合价是+4价,处于中间价态,所以SO2既有氧化性还有还原性。另外SO2还具有漂泊性,能使品红溶液褪色。但SO2的漂白是不稳定的,见光、遇热或长久放置又能恢复为原来的颜色。
考点:考查SO2的性质、用途
点评:本题是常识性知识的考查,主要是有利于培养学生的自学能力,巩固学生对基础知识的熟悉、了解掌握,提高学生的学习效率。
