摘要:碳族元素主要化合价为+2和+4.非金属元素还有-4价.其中Pb+2价稳定,其余的+4价稳定. 典例剖析 [例1]向下列物质的浓溶液中缓慢地通入过量CO2气体.整个过程中无明显现象的是 A.水玻璃 B.苯酚钠 C.漂白粉 D.饱和碳酸钠 E.氯化钙 解析: CO2溶于水生成碳酸.碳酸的酸性比盐酸弱.而比硅酸.次氯酸.苯酚强.根据酸与盐反应的规律.过量CO2通入硅酸钠溶液中有白色沉淀H2SiO3生成.CO2通入苯酚钠溶液中会生成苯酚浊液,CO2通入次氯酸钙溶液过程中会生成碳酸钙白色沉淀.CO2过量最终沉淀会消失,过量CO2通入饱和碳酸钠溶液会生成碳酸氢钠.碳酸氢钠溶解度比碳酸钠溶解度小而结晶析出,CO2通入氯化钙溶液无明显现象. 答案:E. 规律总结: 此题易出错的地方有三个:①CO2通入氯化钙溶液无明显现象,②题干中CO2是过量的,③碳酸氢钠因溶解度小而结晶析出. [例2]将足量CO2通人KOH和Ca(OH)2的混合稀溶液中.生成沉淀的 物质的量(n)和通入CO2体积(y)的关系正确的是 A B C D 解析:CO2通入KOH和Ca(OH)2的混合溶液中.首先发生反应CO2+2OH-+Ca2+=CaCO3↓+H2O.此段时间内随着CO2的不断通入.沉淀量逐渐增加,等Ca(OH)2反应完.溶液中还剩余OH-.再通CO2.即发生反应:CO2+2KOH=K2CO3+H2O.此段时间内.随着CO2的不断通入.沉淀量保持不变; 等KOH反应完.继续通CO2.即发生反应:CaCO3+CO2+H2O=Ca(HCO3)2.沉淀量逐渐减少.一直到沉淀完全溶解.D图象符合题意.实际上这里还有一个定量关系:完全生成碳酸钙沉淀所需的CO2的体积和使碳酸钙沉淀完全溶解所需的CO2的体积相等.答案:D. 规律总结:遇到通入气体沉淀又溶解的这类题.首先联想到碳酸盐.亚硫酸盐转化为酸式盐.当全部转化为正盐时.如有OH-.则应把OH-中和完毕.酸式盐再转化为正盐. [例3]Fe3O4若看作“混合氧化物 时可写成FeO·Fe2O3.若看作一种盐时又可写成Fe(FeO2)2.根据化合价规则和这种书写方法.Pb3O4可以分别写成 和 . 解析: Fe元素有+2.+3价.Fe3O4中有1/3Fe元素为+2价.2/3Fe元素为+3价.与Fe元素不同.铅是+2价.+4价.按化合价规则及题中要求的写法(即低价在前.高价在后.且高价元素形成酸根).故Pb3O4应改写为下列两种形式2PbO·PbO2和Pb2PbO4. [例4] 草酸晶体与浓硫酸共热可制得CO.其化学方程式如下:H2C2O4 CO↑+CO2↑+H2O.现利用该反应制取CO气体.要求:a.验证CO还原性及其氧化产物.b.剩余气体CO不能排入大气中.并回答有关问题: (1)试从图中选用几种装置连接成一套实验装置.所选用的装置及连接顺序为 . (2)用简洁的文字说明所选的装置.如何达到上述两要求:a. ,b. . (3)在装置C中的化学反应方程式为 . (4)本实验有四个酒精灯A.B.C.H.正确操作时点燃酒精灯的顺序是 ,试简单说明理由, .熄灭酒精灯的顺序是 ,试简单说明理由: . (5)用有效气体还原0.40g将生成的气体通入过量澄清石灰水中.生成0.75g白色沉淀.则 中 值是 . 值是 . 解析:在制取气体时.根据方程式:H2C2O4 CO↑+CO2↑+H2O,可知这是一个固体与液体物质在加热条件下制取气体的反应.应选装置A. 因为草酸在加热中分解生成CO时.同时有CO2 和H2O生成.若不除去则影响CO还原性和进行氧化产物CO2 的鉴定.可选用装有苛性钠的U型管以吸收混合气体中的CO2 .同时还要配以装有澄清石灰水的装置E.当气体通过G装置后进行装置E无浑浊出现.说明混合气体中CO2 已除尽.然后通过装有浓H2SO4 的洗气瓶进行干燥.才能进入装置C与 反应.证明CO的还原性. 在C中反应生成Fe和CO2 .证明生成了CO2 .只能再次选用装置E.其中溶液在气体通过后出现浑浊.证明在反应中已生成了CO2 .这就说明了CO的还原性.CO在反应中被氧化为CO2 .剩余CO不能向空气中排放.无其他试剂可以将其吸收.所以将尾气在H处点燃.使未反应的CO转化为CO2 . 实验中有三处装置使用酒精灯.即A.C.H.正确操作点燃酒精灯的顺序应为A→H→C.使分解产生的气体将系统内的空气排净.防止加热时发生爆炸.而熄灭酒精灯的顺序应为C→A→H.这是因为要使已被还原的铁粉在CO的气流中冷却.以防止再被氧化影响实验结果. 实验最后给出测定的有关数值.要求确定 中的 和 值: 中含氧原子的物质的量: ,故 答案:(1)A→G→E→F→C→E→H(2)a.草酸分解气体通过装置E时无白色沉淀生成说明其中所含CO2 已除尽.通过装置C反应后气体通过第二个装置E时出现白色沉淀.说明CO的氧化产物为CO2 .b.尾气在装置H处点燃.使剩余的CO转化为CO2 (3) (4)A→H→C.使分解产生的气体把实验系统内的空气排尽.防止加热时引起爆炸 C→A→H.使热的铁粉在CO气流中冷却.防止铁粉再次被氧化 (5)2.3 知能训练
网址:http://m.1010jiajiao.com/timu3_id_374647[举报]
现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大.已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物.D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素.
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料.通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
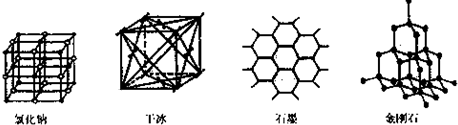
(5)如图是中学常见的几种晶体结构.有关说法正确的是 (填选项).
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的.
查看习题详情和答案>>

请回答以下问题:
(1)请画出F的离子结构示意图:
(2)工业上制取E单质的化学方程式为:
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料.通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式:
(5)如图是中学常见的几种晶体结构.有关说法正确的是
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的.
现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大。已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物。D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素。
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。

A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
查看习题详情和答案>>(18分)现有六种元素A、B、C、D、E、F均为周期表中前20号元素,且原子序数依次增大。已知A和B是形成化合物种类最多的两种元素;B元素和C元素通常形成电子数为14或22的化合物。D元素的原子半径是短周期主族元素中最大的;E元素在地壳中含量居第二位;F是组成人体骨骼的牙齿的主要元素。
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。
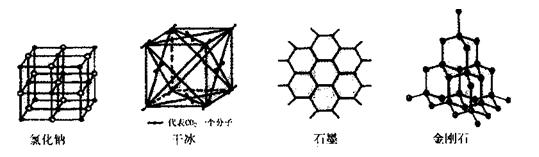
A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
请回答以下问题:
(1)请画出F的离子结构示意图: ;由C、A两种元素形成的18电子化合物的电子式为 ;
(2)工业上制取E单质的化学方程式为: ;
(3)由以上六种元素两两组合所形成的化合物中,既含有离子键又含有非极性共价键的常见化合物有 和 (填化学式);它们都能与水反应生成气体,写出其中一个属于非氧化化还原反应的化学方程式 ;
(4)由A、B两种元素形成的正四面体分子是一种常见的气体燃料。通常状况下1g该物质完全燃烧生成液态水时所释放的能量为51.25kg/mol,请写出表示其燃烧热的热化学方程式: ;
(5)下图是中学常见的几种晶体结构。有关说法正确的是 (填选项)。

A.氯化钠的晶体结构中,和钠离子最近且等距离的氯离子组成了一个正八面体
B.干冰晶体是CO2分子通过范德华力结合形成的
C.石墨晶体中碳原子数与所形成的共从键数目之比为2:3
D.金刚石晶体是由五个碳原子形成的正四面体分子构成的
组成生命细胞的11种常量元素(约占人体总质量的99.97%),全部位于周期表的前20号.其中组成人体蛋白质、脂肪、碳水化合物和核酸的主要有6种元素.
(1)这六种元素中除H、C、O、P、S外,应该还有
(2)CO2是一种温室气体,它的电子式为
 ,将其转变其他化工原料,必须破坏的化学键属于
,将其转变其他化工原料,必须破坏的化学键属于
(3)元素周期表中元素的性质存在递变规律,下列关系正确的是
a.离子半径:S2->Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:
根据表中数据,归纳共价键键能与键长的关系
查看习题详情和答案>>
(1)这六种元素中除H、C、O、P、S外,应该还有
N
N
(写元素符号),它的基态原子核外电子排布式是1s22s22p3
1s22s22p3
,其第一电离能比O的大
大
(填“大”或“小”);与它同周期,且单质熔点最高的元素在周期表中的位置第二周期,IVA族
第二周期,IVA族
.(2)CO2是一种温室气体,它的电子式为


极性
极性
(填“极性”或“非极性”)键.(3)元素周期表中元素的性质存在递变规律,下列关系正确的是
d
d
(填序号).a.离子半径:S2->Na+>O2->H+ b.与水反应的剧烈程度:K>Na>Mg>Ca
c.熔点:CO2>SiO2>Na2O>SO3 d.还原性:PH3>H2S>HCl>HF
(4)下表为部分非金属元素与氢形成共价键的键长与键能数据:
| 共价键 | H-H | H-F | H-Cl | H-Br | H-O | H-S | H-N | H-P |
| 键长(pm) | 74 | 92 | 127 | 141 | 98 | 135 | 101 | 321 |
| 键能(kJ/mol) | 436 | 568 | 432 | 368 | 464 | 364 | 391 | 142 |
同类分子中(同主族元素原子与相同其他原子等合理均可),键长越小,键能越大
同类分子中(同主族元素原子与相同其他原子等合理均可),键长越小,键能越大
.