网址:http://m.1010jiajiao.com/timu3_id_374465[举报]
C(s)+H2O(g)![]() CO(g)+H2(g);DH>0
CO(g)+H2(g);DH>0
已知平衡时,CO为0.12mol.试填空:
(1)若用v(H2O)表示该反应前20s内平均速率,则v(H2O)=________.
(2)若在上述平衡混合物中加入少量Na2O固体,并在此温度下再次达到新的平衡(第二平衡),则平衡时H2的物质的量________(填“增大”“减小”或“不变”).理由是________.
(3)若向上述第一平衡的混合物中再充入amolH2(a<0.12)在相同条件下达到新的平衡(第三平衡),此时CO的物质的量n的范围是________.
查看习题详情和答案>>
 (2012?武汉模拟)一定温度下在固定容积为5.0L的密闭容器中发生可逆反应.
(2012?武汉模拟)一定温度下在固定容积为5.0L的密闭容器中发生可逆反应.I.若某可逆反应的化学平衡常数表达式为:K=
| c(CO)?c(H2) |
| c(H2O) |
(1)写出该反应的化学方程式:
(2)能判断该反应一定达到化学平衡状态的依据是
A.v正(H2O)=v逆(H2)
B.容器中气体的密度不随时间而变化
C.容器中各物质总的物质的量不随时间而变化
D.消耗n mol H2的同时消耗n mol CO
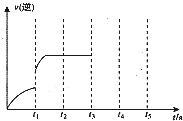
Ⅱ.若该密闭容器中加入的是2.0mol Fe(s)与1.0molH2O(g),t1秒时,H2的物质的量0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol.
(3)t1~t2时间内的化学反应速率v(H2)=
| 0.030 |
| t2-t1 |
| 0.030 |
| t2-t1 |
(4)若继续加入2.0mol Fe(s),则平衡
(5)该反应的逆反应速率随时间变化的关系如图.t1时改变了某种条件,并且未引起K值改变,则改变的条件可能是
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
则N2(g)+3H2(g)=2NH3(g)的△H= 。
(2)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是 。
①增大压强 ②通入He
③使用催化剂 ④降低温度
(3)工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
![]() 。计算该条件下达到平衡时N2转化率为 ;
。计算该条件下达到平衡时N2转化率为 ;
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:(其中c、d均为碳棒,NaCl溶液的体积为500ml)
①b极为 极,电极反应式 ;
c极为 极,电极反应式
②右图装置中,当b极上消耗的O2在标准状况下的体积为280ml时,则乙池溶液的PH为 (假设反应前后溶液体积不变,且NaCl溶液足量)
查看习题详情和答案>>
(1)已知:N2(g)+O2(g)=2NO(g);△H= +180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
则N2(g)+3H2(g)=2NH3(g)的△H= 。
(2)工业合成氨的反应为N2(g)+3H2(g)  2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是 。
①增大压强 ②通入He
③使用催化剂 ④降低温度
(3)工业合成氨的反应为N2(g)+3H2(g)  2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为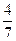 。计算该条件下达到平衡时N2转化率为 ;
。计算该条件下达到平衡时N2转化率为 ;
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:(其中c、d均为碳棒,NaCl溶液的体积为500ml)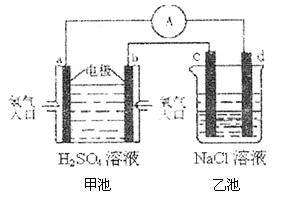
①b极为 极,电极反应式 ;
c极为 极,电极反应式 
②右图装置中,当b极上消耗的O2在标准状况下的体积为280ml时,则乙池溶液的PH为 (假设反应前后溶液体积不变,且NaCl溶液足量)
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol
则N2(g)+3H2(g)=2NH3(g)的△H= 。
(2)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是 。
2NH3(g)。在一定温度下,将一定量的N2和H2通入固定体积为1L的密闭容器中达到平衡后,改变下列条件,能使平衡向正反应方向移动的是 。①增大压强 ②通入He
③使用催化剂 ④降低温度
(3)工业合成氨的反应为N2(g)+3H2(g)
 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为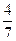 。计算该条件下达到平衡时N2转化率为 ;
。计算该条件下达到平衡时N2转化率为 ;(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行右图所示实验:(其中c、d均为碳棒,NaCl溶液的体积为500ml)
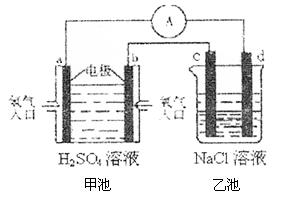
①b极为 极,电极反应式 ;
c极为 极,电极反应式

②右图装置中,当b极上消耗的O2在标准状况下的体积为280ml时,则乙池溶液的PH为 (假设反应前后溶液体积不变,且NaCl溶液足量)