网址:http://m.1010jiajiao.com/timu3_id_374451[举报]

Ⅰ.二氧化碳的吸收
(1)上述流程中“循环”的意义为
(2)吸收池中不用饱和碳酸钠溶液代替饱和碳酸钾溶液可能的原因是
Ⅱ.二氧化碳的利用
(1)2009年我国二氧化碳排放总量约为6.6×109吨,若采用上述流程将二氧化碳转化成甲醇(假设CO2的吸收率为80%,转化率为90%),通过计算确定理论上可制得甲醇多少吨?
(2)工业上常将甲醇加入汽油,制成利于改善城市环境的甲醇汽油.
已知常温下甲醇、汽油及一氧化碳的燃烧热如下:
| 物质 | 甲醇 | 汽油(C8H8) | 一氧化碳 |
| 燃烧热/kJ?mol-l | 725 | 5518 | 283 |
1996年诺贝尔化学奖授予对发现 ![]() 有重大贡献的三位科学家.
有重大贡献的三位科学家.![]() 分子是形如球状的多面体(如图2—20),该结构的建立基于以下考虑:
分子是形如球状的多面体(如图2—20),该结构的建立基于以下考虑:

①![]() 分子中每个碳原子只跟相邻的3个碳原子形成化学键;②
分子中每个碳原子只跟相邻的3个碳原子形成化学键;②![]() 分子只含有五边形和六边形;③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2.据上所述,可推知
分子只含有五边形和六边形;③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2.据上所述,可推知![]() 分子有12个五边形和20个六边形,
分子有12个五边形和20个六边形,![]() 分子所含的双键数为30.请回答下列问题:
分子所含的双键数为30.请回答下列问题:
(1)固体![]() 与金刚石相比较,熔点较高者应是___________,理由是_________.
与金刚石相比较,熔点较高者应是___________,理由是_________.
(2)试估计![]() 跟
跟![]() 在一定条件下能否发生反应生成
在一定条件下能否发生反应生成![]()
![]() (填“可能”或“不可能”)________.并简述其理由:_______.
(填“可能”或“不可能”)________.并简述其理由:_______.
(3)通过计算,确定![]() 分子所含单键数为________.
分子所含单键数为________.
(4)![]() 分子也已制得,它的分子结构模型可以与
分子也已制得,它的分子结构模型可以与![]() 同样考虑而推知,通过计算确定
同样考虑而推知,通过计算确定![]() 分子中五边形和六边形的数目.
分子中五边形和六边形的数目.![]() 分子中所含五边形数为__________,六边形数为________.
分子中所含五边形数为__________,六边形数为________.
(5)德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子,如图2-21所示.这一成果刊登在2000年9月7日出版的英国《自然》杂志上.根据理论计算,包含20个碳原子、仅仅由正五边形构成的![]() 分子是富勒式结构分子中最小的一种.
分子是富勒式结构分子中最小的一种.![]() 中有__________个五边形;共有______条棱边.
中有__________个五边形;共有______条棱边.

(6)目前,科学家拟合成一种“二重构造”的球型分子,即把“足球型”的![]() 与“足球型”的
与“足球型”的![]() 的分子进行重新构造,并使硅原子与碳原子以共价键结合.请回答下列问题:
的分子进行重新构造,并使硅原子与碳原子以共价键结合.请回答下列问题:
①你认为![]() 与
与![]() 的分子应采取怎样的镶嵌_________,理由是________.
的分子应采取怎样的镶嵌_________,理由是________.
②“二重构造”后的晶体属于_________晶体,其熔点与![]() 、
、![]() 相比_______.
相比_______.
(7)最近有人用一种称为“超酸”的化合物![]() 和
和![]() 反应,使
反应,使![]() 获得一个质子,得到一种新型离子化合物
获得一个质子,得到一种新型离子化合物![]() .回答如下问题:
.回答如下问题:
①以上反应类型上可以跟中学化学课本中的一个化学反应相比拟,后者是_______________________.
②上述阴离子![]() 的结构可以跟图2-22的硼二十面体相比拟,也是一个闭合的纳米笼,而且,
的结构可以跟图2-22的硼二十面体相比拟,也是一个闭合的纳米笼,而且,![]() 子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过.请在图2-23中添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子.
子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过.请在图2-23中添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子.



(2)三聚氰胺的结构简式如上图b,根据你的了解,下列关于三聚氰胺的表述中,正确的是___________(填字母序号)。
A.三聚氰胺的熔点可能很高
B.三聚氰胺的含氮量高达67%左右
C.三聚氰胺属于无机化合物
D.三聚氰胺分子中所有原子在同一平面上
(3)①最近科学家们合成了由氮元素形成的N5n+,电子式为
 则n值为_________。
则n值为_________。②H与N能形成化合物NH5,已知该物质与水反应有H2生成,则NH5中含有的化学键为______________。
(4)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为 35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。

②写出G与H反应的离子方程式______________________。
③实验室中I应如何保存?______________________。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式
______________________。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因______________________。
氮元素是生命活动、物质间转化的常见元素。
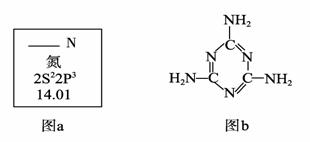
(1)图a是元素周期表中N元素的有关信息,图a中横线上缺失的具体内容是 。
15N是N元素的一种重要核素,其一个原子核中含有的中子数为 。
(2)三聚氰胺的结构简式如上图b,根据你的了解,下列关于三聚氰胺的表述中,
正确的是 (填字母序号)。
A.三聚氰胺的熔点可能很高 B.三聚氰胺的含氮量高达67%左右
C.三聚氰胺属于无机化合物 D.三聚氰胺分子中所有原子在同一平面上
(3)①最近科学家们合成了由氮元素形成的N5n+,电子式![]() 为
为
则n值为 。
②H与N能形成化合物NH5 ,已知该物质与水反应有H2生成,则NH5中含有的化学键为 。
(4)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为
35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。

①写出D与X反应的化学方程式
②写出G与H反应的离子方程式 。
③实验室中I应如何保存? 。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式 。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
查看习题详情和答案>>(18分)X、Y、Z为三种短周期元素,核电荷数依次增大,且X、Y、Z三种元素的原子核外电子层数之和为5。已知X是原子结构最简单的元素,Y元素原子最外电子层上的电子数是其电子数的2倍、Z元素是植物生长的重要营养元素。请回答下列问题:
(1)推断X、Y、Z的元素:X________,Y_________,Z__________(写元素符号)。
(2)Y元素的单质中有一种称为足球稀的分子Y![]() ,它可能最易发生的反应是______。
,它可能最易发生的反应是______。
![]() A.消去反应 B.取代反应 C.加成反应 D.聚合反应
A.消去反应 B.取代反应 C.加成反应 D.聚合反应
(3)Z与X可形成多种化合物,其中ZX![]() 的电子式为________________。(用推断出的X、Z的元素符号表示)
的电子式为________________。(用推断出的X、Z的元素符号表示)
(4)最近科学家们合成了由Z元素形成的Z![]() ,电子式为
,电子式为![]()
则n值____________________。
(5)Z的最高价氧化物对应水化物甲与其气态氢化物乙反应可生成盐丙。
①甲的浓度溶液与Y元素的单质共热的化学反应方程式为_____________________。
②丙对水的电离起____________作用(填“抑制”、“促进”或“不影响”),原因是(用离子方程式表示)_______________________________;
③在一定条件下,将乙放入固定容积的密闭容器中使其发生分解反应,已知![]() ,达到平衡状态后,改变其中一个条件X,Y随X的变化符合图中曲线的是___________(选填字母)
,达到平衡状态后,改变其中一个条件X,Y随X的变化符合图中曲线的是___________(选填字母)
a.当X表示温度时,Y表示乙的物质的量
b.当X表示压强时,Y表示乙的转化率
c.当X表示反应时间时,Y表示混合气体的密度
(6)若X的单质的燃烧热为M KJ![]() ,试写出其单质在空气中燃烧的热化学方程式:__________________________。
,试写出其单质在空气中燃烧的热化学方程式:__________________________。