网址:http://m.1010jiajiao.com/timu3_id_374336[举报]
原电池、电解(电镀)池是化学反应利用方面的典型事例,体现出能量之间的转换,受到越来越多的关注。按要求回答下列各个问题。
(1)南昌大学最近研发出一种新型纳米锂电池,已跻身国内领先地位。锂离子电池的正极材料是锂过渡金属氧化物(例如LiCoO2)混以一定量的导电添加物(例如C)构成的混合导体,负极材料是可插入锂的碳负极。两极的电极反应式:
负极:![]() 正极:
正极:![]() 。
。
充、放电时电池中的变化简单表示为:![]() (a、b、c、d表示充放电过程)。其中表示充电时阴极发生变化的过程是 (填a、b、c、d),判断理由是 。
(a、b、c、d表示充放电过程)。其中表示充电时阴极发生变化的过程是 (填a、b、c、d),判断理由是 。
(2)在正负极之间是固体电解质。固体电解质又称离子导体,在一定温度范围内具有很强的导电性。固体电解质虽然是固体,但却像电解质溶液一样为离子的导电载体。下列物质能作为固体电解质的是 (填编号)。
①特种钢;②硝酸钾晶体;③银;④高纯度硅。
(3)实验室中用该类电池在铁棒上镀铜,当有lmol电子发生转移时,则正极产生物质的质量为 g。
(4)为了使产品更耐腐蚀和美观,通常采用电镀的方式,但随之而来的是污染问题。某电镀厂处理有氰电镀的废水时,用Ti02作催化剂,用NaCl0将CN-离子氧化成CNO-,CNO-在酸性条件下继续被NaClO氧化成N2和C02;用如图装置实验,通过测定二氧化碳的量确定CN-的含量。将浓缩后含CN-离子200mL的污水与过量NaClO溶液的混合液,倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
①甲中反应的离子方程式为_____________

②乙中除生成N2和C02外,还有HCl及副产物Cl2等。在上述装置中HCl和C12是如何被除掉的?______。
③实验后得到0.4吧沉淀,则浓缩后的污水中CN-的含量为 g/L。
查看习题详情和答案>>Ⅰ.(1)N2H4中的N原子最外层达到8电子稳定结构,写出N2H4的结构式_____________。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 。
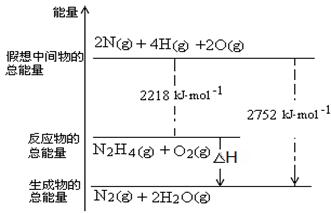
(3)肼是一种高能燃料,有关化学反应的能量变化如右图所示,写出肼燃烧的热化学方程式 。
Ⅱ.氨的合成是最重要的化工生产之一。已知:
N2(g)+3H2(g)
 2NH3(g)ΔH=-92.4 kJ·mol-1
2NH3(g)ΔH=-92.4 kJ·mol-1在3个体积均为2L的密闭容器中,在相同的温度下,使用相同的催化剂合成氨,实验测得反应在起始、达到平衡时的有关数据如下表所示:

试回答:
(1)下列各项能说明该反应已达到平衡状态的是______________(填写序号字母)。
a.容器内N2、H2、NH3的浓度之比为1︰3︰2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
(2)分析上表数据,下列关系正确的是_________(填写序号字母)。
| A.2c1>1.5mol·L-1 | B.w3=w1 | C.2ρ1=ρ2 | D.K甲= K乙= K丙 |
III.直接供氨式碱性燃料电池的电池反应式是4NH3+3O2=2N2+6H2O,电解质溶液一般使用KOH溶液,则负极电极反应式是__________ 。
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多l,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀。各物质间的转化关系如下图所示(反应条件多数已略去);
请回答:
(1)反应⑥的离子方程式是
(2)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是
(3)在反应①中,已知lgB,完全燃烧生成液态D时,放出142.9KJ的热量,则表示B燃烧热的热化学方程式是
(4)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是
(5)反应③④在通常情况下不能自发进行,框图中的条件a是 ,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式
查看习题详情和答案>>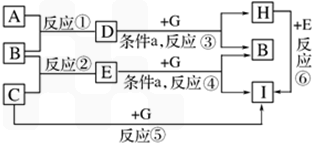
(1) 在反应①中,已知1 g B完全燃烧生成液态D时,放出142.9 kJ的热量,则表示B的燃烧热的热化学方程式是____________________________________________。
(2)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是_______________________________________________。
(3) 反应③④在通常情况下不能自发进行,框图中的条件a是________,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式___________。
(4) 反应⑥的离子方程式是_______________________________________________。
(5) 甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是________。
单质A、B、C在常温下均为气态,分别由甲、乙、丙三种短周期元素组成;已知丙元素的原子结构中次外层电子数比最外层电子数多1,化合物D在常温下呈液态,G是常见的金属单质,H是常见的蓝色沉淀,各物质间的转化关系如图所示(反应条件多数已略去):

请回答:
(1)反应⑥的离子方程式是________.
(2)甲、乙两元素除形成化合物D外,还可形成一种含有4个原子核和18个电子的化合物,该化合物的电子式是________.
(3)在反应①中,已知1 g B完全燃烧生成液态D时,放出142.9 kJ的热量,则表示B的燃烧热的热化学方程式是________.
(4)反应①也可以设计成原电池装置进行,当用铂作电极,用KOH溶液作电解质溶液时,负极的电极反应式是________.
(5)反应③④在通常情况下不能自发进行,框图中的条件a是________,在使反应③④能够发生的装置中,有一个电极材料必须相同,写出该电极反应式________.