网址:http://m.1010jiajiao.com/timu3_id_373696[举报]
 铁是人类生产和生活中必不可少的重要金属(如图).
铁是人类生产和生活中必不可少的重要金属(如图).(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为
(2)铁原子中有
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
(6)0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况).将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积
铁是人类生产和生活中必不可少的重要金属。

(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___________。
计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%……是指各同位素的____________________。
(2)铁原子中有______种能量不同的电子,铁原子次外层的电子云有_____种不同的伸展方向。
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为________________________________。
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于_________极,电解质溶液是____________________。
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
___Fe(NO3)3 + ___NaOH + ___Cl2 →___Na2FeO4 + ___NaNO3 + ___NaCl + ___H2O
高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是______________________。
(6)0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况)。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积________________L。
查看习题详情和答案>>

(此转化关系中所用的试剂都是足量的)
(1)写出下列物质的化学式:F
(2)将混合物中两种金属分离开的最简单的方法是
(3)D→E的转化中,加入过量的X可能是
(4)写出下列转化的方程式:
A→C(离子方程式):

请回答:
(1)山梨酸中无氧官能团的名称是
(2)鉴别桂醋和尼泊尔金甲酯的试剂为
(3)1mol尼泊尔金甲酯与NaOH溶液反应最多消耗NaOH


条件一:和尼泊金甲酯一样,苯环上有两个取代基,其中一个为羟基,另一个取代基在羟基的对位
条件二;能与新制备氢氧化铜悬浊液反应.
(4)已知:-CHO
| ||
| CH3OH |
| ||
| H+ |

①A→B的反应类型为
②试剂X为


③若F为高分子聚合物,且每个链节上只有两处碳原子,则反应E→F的化学方程式为

| 浓H2SO4 |
| △ |


| 浓H2SO4 |
| △ |

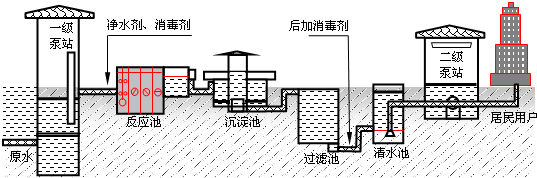
(1)生产中用到净水剂,下列物质有净水作用的是
A.石灰石 B.氧化铁 C.氯化铁 D.明矾
(2)上图生产流程中常用的消毒剂是氯气,写出氯气与水反应的离子方程式
 HClO+H++Cl-
HClO+H++Cl- HClO+H++Cl-
HClO+H++Cl-(3)生产过程中两次加入消毒剂,其中“后加消毒剂”的目的是
A.使供水管网保持足够的余氯,防止水在管网中再次受到污染
B.氯气有毒,且很不稳定,一次加入会加大自来水的毒性
C.如果一次性加入,氯气会堵塞管网,所以必须分两次加入
D.氯气难溶于水,一次加入时难全部溶解
(4)上述消毒用的氯气是电解饱和食盐水制取的,写出阴极的电极反应式