摘要:9.充分煅烧黄铁矿Wg.反应完全后冷却至室温.称得固体物质的质量是mg.生成SO2为 VL.则黄铁矿中FeS2的质量分数是(假设矿石中的杂质受热不分解.也不会与SO2反应)( ) A.60V/22.4W B.22.4V/60W C.80V/22.4W D.3(W-m)/W
网址:http://m.1010jiajiao.com/timu3_id_372997[举报]
充分煅烧黄铁矿Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为VL,则黄铁矿中FeS2的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应)
- A.60V/22.4W
- B.22.4V/60W
- C.80V/22.4W
- D.3(W-m)/W
|
充分煅烧黄铁矿Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为VL,则黄铁矿中FeS2的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应) | |
| [ ] | |
A. |
60V/22.4W |
B. |
22.4V/60W |
C. |
80V/22.4W |
D. |
3(W-m)/W |
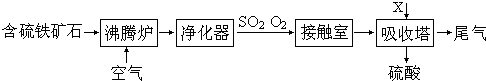
以含硫铁矿石为原料生产硫酸的工艺流程图如下:

请回答下列问题:
(1)将燃烧含硫铁矿石的化学方程式补充完整:4______+11O2 2Fe2O3+8SO2.
2Fe2O3+8SO2.
充分煅烧含硫铁矿石Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为VL,则含硫铁矿石中硫元素的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应)______.
A.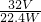 B.
B.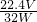 C.
C.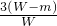 D.
D.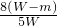
(2)接触室中发生反应的化学方程式是______.
某温度下,进入接触室内SO2和O2的物质的量比为1:1,反应达到平衡时,压强减少 ,则SO2的转化率为______.
,则SO2的转化率为______.
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)______.
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔用于吸收SO3气体的X物质是______(写名称).
已知每240g SO3气体与H2O化合放出390.9kJ的热量,该反应的热化学方程是______.
(5)排出的尾气SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是______.
查看习题详情和答案>>
以含硫铁矿石为原料生产硫酸的工艺流程图如下:

请回答下列问题:
(1)将燃烧含硫铁矿石的化学方程式补充完整:4
2Fe2O3+8SO2.
充分煅烧含硫铁矿石Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为VL,则含硫铁矿石中硫元素的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应)
A.
B.
C.
D.
(2)接触室中发生反应的化学方程式是
某温度下,进入接触室内SO2和O2的物质的量比为1:1,反应达到平衡时,压强减少
,则SO2的转化率为
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔用于吸收SO3气体的X物质是
已知每240g SO3气体与H2O化合放出390.9kJ的热量,该反应的热化学方程是
(5)排出的尾气SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是
查看习题详情和答案>>

请回答下列问题:
(1)将燃烧含硫铁矿石的化学方程式补充完整:4
FeS2
FeS2
+11O2
| ||
充分煅烧含硫铁矿石Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为VL,则含硫铁矿石中硫元素的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应)
D
D
.A.
| 32V |
| 22.4W |
| 22.4V |
| 32W |
| 3(W-m) |
| W |
| 8(W-m) |
| 5W |
(2)接触室中发生反应的化学方程式是
2SO2+O2
3SO3
| 催化剂 |
| △ |
2SO2+O2
3SO3
.| 催化剂 |
| △ |
某温度下,进入接触室内SO2和O2的物质的量比为1:1,反应达到平衡时,压强减少
| 1 |
| 5 |
80%
80%
.(3)依据工艺流程图判断下列说法正确的是(选填序号字母)
abd
abd
.a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔用于吸收SO3气体的X物质是
浓硫酸
浓硫酸
(写名称).已知每240g SO3气体与H2O化合放出390.9kJ的热量,该反应的热化学方程是
SO3(g)+H2O(l)═H2SO4(l);△H=-130.3kJ/mol
SO3(g)+H2O(l)═H2SO4(l);△H=-130.3kJ/mol
.(5)排出的尾气SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是
SO2+Br2+2H2O═4H++2Br-+SO42-
SO2+Br2+2H2O═4H++2Br-+SO42-
.以含硫铁矿石为原料生产硫酸的工艺流程图如下:
请回答下列问题:
(1)将燃烧含硫铁矿石的化学方程式补充完整:4______+11O2
2Fe2O3+8SO2.
充分煅烧含硫铁矿石Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为VL,则含硫铁矿石中硫元素的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应)______.
A.
B.
C.
D.
(2)接触室中发生反应的化学方程式是______.
某温度下,进入接触室内SO2和O2的物质的量比为1:1,反应达到平衡时,压强减少
,则SO2的转化率为______.
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)______.
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔用于吸收SO3气体的X物质是______(写名称).
已知每240g SO3气体与H2O化合放出390.9kJ的热量,该反应的热化学方程是______.
(5)排出的尾气SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是______.
查看习题详情和答案>>

请回答下列问题:
(1)将燃烧含硫铁矿石的化学方程式补充完整:4______+11O2
| ||
充分煅烧含硫铁矿石Wg,反应完全后冷却至室温,称得固体物质的质量是mg,生成SO2为VL,则含硫铁矿石中硫元素的质量分数是(假设矿石中的杂质受热不分解,也不会与SO2反应)______.
A.
| 32V |
| 22.4W |
| 22.4V |
| 32W |
| 3(W-m) |
| W |
| 8(W-m) |
| 5W |
(2)接触室中发生反应的化学方程式是______.
某温度下,进入接触室内SO2和O2的物质的量比为1:1,反应达到平衡时,压强减少
| 1 |
| 5 |
(3)依据工艺流程图判断下列说法正确的是(选填序号字母)______.
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔用于吸收SO3气体的X物质是______(写名称).
已知每240g SO3气体与H2O化合放出390.9kJ的热量,该反应的热化学方程是______.
(5)排出的尾气SO2既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2.SO2吸收Br2的离子方程式是______.