摘要:21.一氢气球下系一小重物G.重物只在重力和绳的拉力作用下做直线运动.不计空气阻力和风力影响.而重物运动方向如图中箭头所示的虚线方向.图中气球和重物G在运动中所处的位置可能是
网址:http://m.1010jiajiao.com/timu3_id_372908[举报]
(2012?开封一模)[选修2-化学与技术]合成氨的流程示意图如下:

回答下列问题:
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为
(2)设备B中m和n是两个通水口,入水口是
(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是
(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
①依据上表信息,你认为采用
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ/mol;
2CO2(g)+O2(g)═CO2(g)△H=-566kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:
查看习题详情和答案>>

回答下列问题:
(1)设备A中含有电加热器,触媒和热交换器,其中发生的化学反应方程式为
N2+3H2
2NH3
| 催化剂 |
| 高温高压 |
N2+3H2
2NH3
,设备A的名称是| 催化剂 |
| 高温高压 |
合成塔
合成塔
;(2)设备B中m和n是两个通水口,入水口是
n
n
(填“m”或“n”).不宜从相反方向通水的原因是高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好
高温气体从冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好
;(3)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是
液化
液化
,分馏
分馏
;(4)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J?t-1 | 28109 | 38109 | 48109 |
天然气
天然气
为原料最好;②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
CH4+H2O
CO+3H2
| ||
| 催化剂 |
CH4+H2O
CO+3H2
;
| ||
| 催化剂 |
③已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
C(s)+O2(g)═CO2(g)△H=-394kJ/mol;
2CO2(g)+O2(g)═CO2(g)△H=-566kJ/mol;
2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol;
试写出由C与水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
C(S)+H2O(g)
CO(g)+H2(g) △H=+131KJ/mol
| ||
C(S)+H2O(g)
CO(g)+H2(g) △H=+131KJ/mol
;
| ||
(5)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的理由:
移走氨气,减小生成物浓度,平衡右移,有利于氨合成
移走氨气,减小生成物浓度,平衡右移,有利于氨合成
.(2009?三明一模)下表中,对第Ⅰ、Ⅱ栏判断都正确的是
|
查看习题详情和答案>>
氨在国民经济中占有重要的地位,请参与下列探究.
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.
C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K
该反应在低温下能否自发 (填:能或否).
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)的K=0.5,
①2NH3(g)?N2 (g)+3H2(g)的K= (填数值).
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正 V(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是 (填序号).
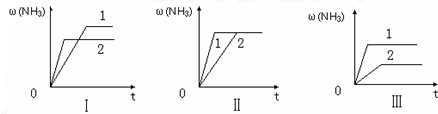
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2.
查看习题详情和答案>>
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气.
C(s)+H2O(g)?H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K
该反应在低温下能否自发
(2)已知在400℃时,N2 (g)+3H2(g)?2NH3(g)的K=0.5,
①2NH3(g)?N2 (g)+3H2(g)的K=
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正
(3)在三个相同容器中各充入1molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如图.下列说法正确的是

A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能,1>2.
(2013?崇明县一模)下表是元素周期表的一部分,请根据表中a~k对应元素,回答下列有关问题:
(1)写出a的原子的最外层电子排布式
(2)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是
(3)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序:
(4)下列能用作f和g元素非金属性强弱比较的判断依据的是…
A.单质熔点:g<f
B.最高价氧化物对应水化物的酸性:g>f
C.最高价氧化物对应水化物的溶解性:g>f
D.f不能与氢气反应,g能与氢气反应.
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | ||
| 4 | j | k |
2s22p3
2s22p3
,a的原子最外层有3
3
个未成对电子.(2)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是
HClO4
HClO4
;最强碱与两性氢氧化物反应的化学方程式为:KOH+Al(OH)3=KAlO2+2H2O
KOH+Al(OH)3=KAlO2+2H2O
.(3)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序:
S2->Cl->K+
S2->Cl->K+
(用离子符号表示),上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,已知常温下该物质的水溶液显碱性,其原因是F-+H2O?HF+OH-
F-+H2O?HF+OH-
(用离子方程式表示).(4)下列能用作f和g元素非金属性强弱比较的判断依据的是…
BD
BD
A.单质熔点:g<f
B.最高价氧化物对应水化物的酸性:g>f
C.最高价氧化物对应水化物的溶解性:g>f
D.f不能与氢气反应,g能与氢气反应.
利用如图1所示实验装置可以测定一条条件下1mol气体的体积,图1中仪器C称为液体量瓶,瓶颈上有110~130mL刻度线.将一定质量的镁带和过量的衡硫酸在仪器A瓶中完全反应,产生的H2将B瓶中的液体压入液体量瓶中,根据液体的体积可以转换成H2的体积.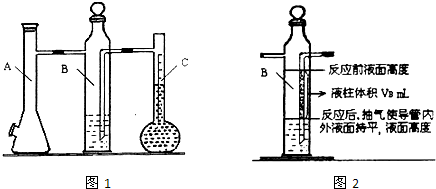
实验步骤:
(1)装配好化学反应气体体积测定仪,作气密性检查.
(2)用砂皮擦去镁带表面的氧化物,然后称取0.100g~0.110g的镁带,把数据记录于表格.
(3)取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口.
(4)用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平.
(5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将破酸注入A瓶,注入后迅速拔出针头.
(6)当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格.
(7)用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格.
重复上述操作进行第二次实验,避免偶然误差.
根据上述实验方法回答下列问题:
实验室温度:25℃,压强:101kPa.该条件下1mol氢气体积的理论值:为24.5L
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞, 可以确认装置气密性合格.
(2)B中所装液体一般是 (填“水”或“品红”).A中发生反应的离子方程式为 .
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
①上表中X= .
②计算1mol氢气体积两次实验的平均值= L.
③计算实验误差:(实验值-理论值)/理论值×100%= .
④引起该误关的可能原因 (填字母).
A.镁带中含有跟硫酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝
D.所用稀硫酸不足量
(4)许多同学在实验中测得的数据偏高(记录数据时已恢复至室温).为此,某化兴趣小组的同学对此实验方案提出了两条修正建议:
①A、B瓶的气体中含有水汽,增加的气体体积中所含的水汽,不该计入氢气的体积.
②B瓶中导管(图2中阴影部分VB)内液柱部分在反应后为空气所占据,不该计入氢气的体积.
你认为他们的意见合理的是 (合理则填序号,否则填“无”).如有合理之处,请根据下面的数据给出修正的1mol氢气体积的数学表达式.(镁元素的相对原子质量为24.3)
1mol氢气体积= L(填写数学表达式).
查看习题详情和答案>>

实验步骤:
(1)装配好化学反应气体体积测定仪,作气密性检查.
(2)用砂皮擦去镁带表面的氧化物,然后称取0.100g~0.110g的镁带,把数据记录于表格.
(3)取下A瓶加料口的橡皮塞,用小烧杯加入20mL水,再把已称量的镁带加到A瓶的底部,用橡皮塞塞紧加料口.
(4)用注射器从A瓶加料口处抽气,使B瓶导管内外液面持平.
(5)用注射器吸取10mL 3mol/L硫酸,用针头扎进A瓶加料口橡皮塞,将破酸注入A瓶,注入后迅速拔出针头.
(6)当镁带完全反应后,读取C瓶中液体的体积,把数据记录于表格.
(7)用注射器从A瓶加料口处抽气,使B瓶中导管内外液面持平,记录抽出气体的体积,把数据记录于表格.
重复上述操作进行第二次实验,避免偶然误差.
根据上述实验方法回答下列问题:
实验室温度:25℃,压强:101kPa.该条件下1mol氢气体积的理论值:为24.5L
(1)连接装置及气密性检查:当A瓶加料口塞上橡胶塞,
(2)B中所装液体一般是
(3)实验数据如下:温度:25℃(镁元素的相对原子质量为24.3)
| 实验次数 | m(Mg)/g | 硫酸体积/mL | 液体量瓶中液体体积/mL | 抽出气体体积/mL | 氢气体积/mL | 计算1mol氢体积/L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | X | |
| 2 | 0.115 | 10.0 | 121.0 | 8.0 |
②计算1mol氢气体积两次实验的平均值=
③计算实验误差:(实验值-理论值)/理论值×100%=
④引起该误关的可能原因
A.镁带中含有跟硫酸不反应的杂质
B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝
D.所用稀硫酸不足量
(4)许多同学在实验中测得的数据偏高(记录数据时已恢复至室温).为此,某化兴趣小组的同学对此实验方案提出了两条修正建议:
①A、B瓶的气体中含有水汽,增加的气体体积中所含的水汽,不该计入氢气的体积.
②B瓶中导管(图2中阴影部分VB)内液柱部分在反应后为空气所占据,不该计入氢气的体积.
你认为他们的意见合理的是
| 实验次数 | m(Mg) g |
硫酸体积mL | 液体量瓶中液体体积mL | 抽出气体体积mL | B瓶的一段液柱体积mL | 水汽体积百分含量 | 计算1mol氢体积L |
| 1 | 0.100 | 10.0 | 110.0 | 6.5 | VB | a% |