网址:http://m.1010jiajiao.com/timu3_id_372685[举报]
(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | | 6 | 8 |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 | 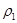 |  | |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
a.容器内H2、N2、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c.
 d.混合气体的密度保持不变
d.混合气体的密度保持不变e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为
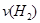 =
= (3)在该温度下甲容器中反应的平衡常数K (用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是 (填序号):
a.
 b.氮气的转化率:
b.氮气的转化率: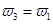 c.
c. 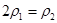 d.
d.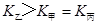
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到
 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
查看习题详情和答案>>
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
查看习题详情和答案>>
(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
达到平衡的时间/min |
| 6 | 8 |
平衡时 N2的体积密度 | C1 | 1.5 |
|
混合气体密度/g·L-1 |
|
|
|
平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
(1)下列各项能说明该反应已到达平衡状态的是 (填写序号字母)
a.容器内H2、N2 、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c. d.混合气体的密度保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为 =
=
(3)在该温度下甲容器中反应的平衡常数K (用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是 (填序号):
a. b.氮气的转化率:
b.氮气的转化率: c.
c.  d.
d.
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
查看习题详情和答案>>
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)
 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:相持恒温、恒容,测的反应达到平衡时关系数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
| 达到平衡的时间/min | | 6 | 8 |
| 平衡时 N2的体积密度 | C1 | 1.5 | |
| 混合气体密度/g·L-1 | 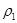 | 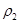 | |
| 平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
a.容器内H2、N2、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c.
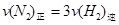 d.混合气体的密度保持不变
d.混合气体的密度保持不变e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为
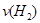 =
= (3)在该温度下甲容器中反应的平衡常数K (用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是 (填序号):
a.
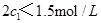 b.氮气的转化率:
b.氮气的转化率: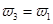 c.
c. 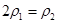 d.
d.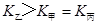
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到
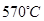 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
①下列措施中可提高氢气的转化率的有
A.升高温度 B.使用催化剂
C.增大压强 D.循环利用和不断补充氮气
②在一定温度和压强下,将H2和N2按体积比3:1在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数为
| 1 |
| 7 |
(3)某厂每天产生600m3含氨废水(NH3 的浓度为153mg?L-1,废氨水密度为1g?cm-3).该厂处理废水的方法:将废水加热得到NH3,使废水中NH3的浓度降为17mg?L-1.再对加热蒸发得到的NH3用一定量空气氧化.发生的主反应如下:
4NH3+5O2
| ||
副反应为:4NH3+3O2=2N2+6H2O
①该厂每天通过加热蒸发可得到NH3的物质的量是多少?
②若氧化过程中90% NH3转化为硝酸,10% NH3发生了副反应,则该厂每天消耗标准状况下的空气多少立方米?(假设废水加热前后的体积和密度近似认为不变,空气中氧气的体积分数20%.)
(1)下表为不同温度下该反应的平衡常数.由此可推知,表中T1______573K(填“>”、“<”或“=”).
| T/K | T1 | 573 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
①下列措施中可提高氢气的转化率的有______(填字母).
A.升高温度 B.使用催化剂
C.增大压强 D.循环利用和不断补充氮气
②在一定温度和压强下,将H2和N2按体积比3:1在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的体积分数为
| 1 |
| 7 |
(3)某厂每天产生600m3含氨废水(NH3 的浓度为153mg?L-1,废氨水密度为1g?cm-3).该厂处理废水的方法:将废水加热得到NH3,使废水中NH3的浓度降为17mg?L-1.再对加热蒸发得到的NH3用一定量空气氧化.发生的主反应如下:
4NH3+5O2
| ||
副反应为:4NH3+3O2=2N2+6H2O
①该厂每天通过加热蒸发可得到NH3的物质的量是多少?
②若氧化过程中90% NH3转化为硝酸,10% NH3发生了副反应,则该厂每天消耗标准状况下的空气多少立方米?(假设废水加热前后的体积和密度近似认为不变,空气中氧气的体积分数20%.)